|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(一)
物質組成的早期理論與學說 A、 希臘哲學家【留基伯】(Leucippus)和他的學生【德謨克利特】(Democritus)早在二千三百多年前 就認為:把金箔切成兩半,所成的兩片還是金,如此一直切下去,會得到一種極為微小的粒子,這種不能分割的微小粒子,稱為【原子】。
(1)
不同物質的原子大小、形狀不相同。
(2)
【原子】是永恆的;不會無中生有,也不會突然消失。
(3)
原子可經由【結合】、【分離】及【重組】形成各種物質。 B、 由於當時的原子理論只能存在於推論而無法證明,因此始終未被普遍接受。 (二)
道耳吞原子說 A、
十九世紀初,英國科學家道耳吞根據一些實驗的結果,提出了【原子說】。 道耳吞認為:
(1)
一切物質都是由稱為【原子】的微小粒子所組成,這種粒子【不能】再分割。
(2)
相同元素的原子,其原子質量與原子大小均【相同】;
(3)
【化合物】是由不同種類的原子以固定的比例組成的。
(4)
所謂【化學】反應,是原子間以新的方式重新結合成另一種物質,反應的過程中,原子不會改變它的【質量】或【大小】,也不會產生新的原子,或使任何一個原子消失。 B、
道耳吞的原子說雖然可以圓滿地解釋當時許多實驗所觀察的結果,但是仍受限於:
(1)
科學理論與儀器的不足,無法測出原子真正的質量。為了化學計量的需要,他採取不同原子間相對質量的倍數,以表示不同原子間的質量關係,此種倍數關係稱為原子量。
(2)
隨著科學的發展,道耳吞原子說也顯現出錯誤,例如原子可以再分割成更小的粒子。
(3)
西元1896年,俄國的科學家門得列夫發現,將元素依照【原子量】的大小排列時,化學性質相近的元素呈現週期性的變化,即為最早期的【週期表】。 (三)
物質的組成及特性 A、
道耳吞認為:一切物質都是由稱為原子的微小粒子所組成,這種粒子不能再分割。 B、
根據後來的學者研究結果顯示,許多物質是以【分子】的型態存在。 C、
具有【物質】特性的最小粒子稱為【分子】。 D、
分子可由一個或數個相同原子組成的; E、
單原子分子: F、雙原子分子: G、
化合物: H、
金屬是由【原子】堆積而成,沒有單獨的【原子】,所以金屬原子有該金屬的特性。 I、 氫氣在【氧氣】中燃燒會產生【水蒸氣】。 (四)
化學反應的模型 A、
根據道耳吞原子說,以模型來說明氫氣燃燒產生水的化學反應。
(1)
(2)
當發生化學反應時,【原子】重新組合,形成新的【分子】,但是原有的原子不會消失,也不會產生新原子。 A、
道耳吞的原子說可以圓滿地解釋【質量守恆】定律: (一)
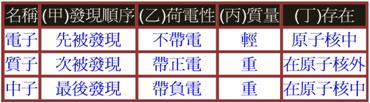
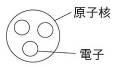
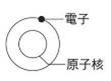
構成原子的粒子 A、 道耳吞的【原子說】認為【原子】是構成物質的最小粒子,但到十九世紀末期,從許多實驗的結果發現,原子也能夠再分成更小的粒子。 B、 西元1897年,湯木生成功地從原子中分離出帶【負電】的【電子】,並認為原子應該是密度【均勻】且帶【正電】的球體,而帶【負電】的電子分布在原子中,就像是布丁中的葡萄乾一般。 C、 西元1911年,拉塞福由實驗結果發現原子大部分是空空洞洞,沒有任何東西存在,而在原子的中心,有一個體積很小,質量很大的極小區域,稱為【原子核】,電子受到原子核的吸引,而環繞原子核旋轉,如同太陽系中的行星繞太陽旋轉一般。 D、 構成原子的粒子:【電子】、【質子】、【中子】。
D、 電子、質子、中子的比較: (1) 電子、質子、中子的發現順序:【電子】最先被發現,其次為【質子】和【中子】。 (2) 電子、質子、中子的帶電性: (A) 電子帶【負電】,它是【電荷】的最小單位。 (B) 質子帶【正電】、電量與一個【電子】所帶的電量【相等】,但電性【相反】。 (C) 中子帶【中性電】。 (3) 電子、質子、中子質量:【質子】質量=【中子】質量=1840倍(電子質量)。 (二)
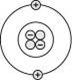
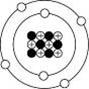
拉塞福的原子模型 A、 (1)
原子是由【原子核】與核外的【電子】構成。 (2)
原子核帶【正電】,位居【原子中央】,體積【極小】,而質量比【電子】大很多。電子受【原子核】吸引環繞【原子核】做旋轉運動。 (3)
電子運動的範圍即視為【原子】的大小。 (4)
如果把【電子】在原子核外運動的範圍假想為操場,則【原子核】的大小就如同在操場中心的十元硬幣的大小。 (三)
原子的帶電、質量與特性: A、 原子的帶電情形: (1) 原子保持【電中性】: (A)
經由許多科學家不斷的研究,發現原子核是由帶【正電】的【質子】和【不帶電】的【中子】所構成。 (B)
一個【質子】所帶的電與一個【電量】所帶的電量一樣多,但二者的電性【相反】,【質子】數與【電子】數相等,使整個原子保持【電中性】。 (2) 帶電的原子: (A)
由於質子位於【原子核】內,其數目不會增加,也不會減少,一般物質帶電,都是【自由電子】轉移的結果。 (B)
帶正電的原子: (C)
帶負電的原子: B、 當毛皮與塑膠尺摩擦後,塑膠尺會帶【負電】,毛皮帶【正電】。 C、 原子的質量: (1)
【中子】雖然不帶電,但其質量與【質子】非常接近,而【質子】的質量大約是【電子】的【1840】倍,所以整個原子的質量幾乎全部集中在【原子核】。
即原子的質量≒【質子】數+【中子】數 D、 質子數決定原子的性質: (1) 原子的性質和其【質子】數有關:兩原子若其核內的【質子】數不同,則原子的性質就不同。 (2) 同一種元素的原子,其【質子】必相同;不同元素的原子,其【質子】必不同。 (四)
原子及離子 A、 一般的化學反應,一個原子的外圍電子較容易失去或獲得,稱為【自由】電子; B、 一個中性原子其原子核中所帶正電的總電量,應等於核外電子所帶的總電量,因此原子成電中性。 C、 當原子失去電子時,此時原子內的電子總數【減少】,使得原子內的正電總量【大於】核外的負電總量,因此原子帶【正電】,形成【陽離子】。 D、 當原子獲得電子時,此時原子內的電子【增加】,使得原子內的正電總量【小於】核外的負電總量,因此原子帶【負電】,形成【[陰離子】。 E、 同一種元素的原子和離子性質【不同】。 【補充】: 1.
化學反應的變化: 甲、一定保持不變:
(1)
原子質量。
(2)
原子種類。
(3)
原子個數。
(4)
原子性質。 乙、可能保持不變:
(1)
分子個數。
(2)
分子體積。 丙、一定會改變:
(1)
原子排列。
(2)
分子性質。
(3)
分子種類。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
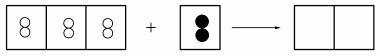
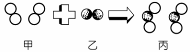
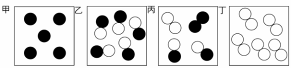
◎元素、化合物與原子、分子 以○代表A原子、◎代表B原子,試回下列問題: (甲)○○ (乙)○○○ (丙)◎◎ (丁)◎○◎ (戊)◎○○◎。 (1)
那些是元素?【甲乙丙】;那些是化合物?【丁戊】。 (2)
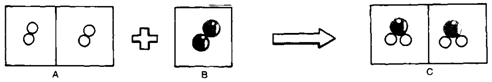
何者可代表水分子?【丁】; ◎化學變化的模型 如圖,為氫氣和氧氣化合成水分子的模型,請回答下列問題: (1)
氫氣和氧氣化合成水分子的反應是屬於【化學】變化,【放熱】反應。 (2)
(3)
反應過程中氫、氧原子的排列方式和水分子的排列方式【不同】。 (4)
反應前後氫、氧原子總數【不變】,原子的種類【不變】。 (5)
除(4)之外,各原子的質量也沒改變,故反應前所有物質的總質量恆【等於】反應後物質的總質量,故可圓滿解釋【質量守恆】定律。 ◎化學變化的模型
(1) 由圖知:A、B、C中共含有幾種原子?【2種】。 (2) 在C中,A、B兩種原子的個數比為【2:1】。 (3) 100個A和100個B反應可得C【100】個。 (4) 若每一個A原子質量為B的3倍,則C中A、B兩元素的質量比為【6:1】。 ◎物、分子的模型 以「○』代表氧原子,「●』代表碳原子,試回答下列問題
(1) 在自然界能以原子狀況單獨存在者有【B】; (2) 以化合物狀況存在的有【D、F】;由一種元素所組成的物質有【B、C、E】。 (3) 承上題,屬於同一種元素的物質有【C、E】。 (4) 是元素的分子者有【B、C、E】。 ◎元素、化合物與原子、分子 以○代表A原子、◎代表B原子,試回下列問題: (甲)○○ (乙)○○○ (丙)◎◎ (丁)◎○◎ (戊)◎○○◎。 (1) 那些是元素?【甲乙丙】;那些是化合物?【丁戊】。 (2) 何者可代表水分子?【丁】。 何者代表氧分子?【甲】。 ◎原子的結構模型
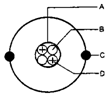
(1) 圖中A為【原子核】,B為【中子】,C為【電子】,D為【質子】。 (2) 此原子呈電中性時,質子數為【2】,中子數為【2】,電子數為【2】。 ◎各種原子中的質子數、中子數和電子數
試參考右表,並回答下列問題: (1) 原子核內含有最多中子的元素是【Fe】。 (2) 原子核內中子數和核外電子數恰相等的元素有【C、O、Mg】。 ◎化合物中的質子、中子和電子 已知質子數:C=6,O=8,H=1;原子質量:C=l2,O=16,H=1,試問: (1) 一個二氧化碳(CO2)分子中,含質子數【22】個,中子數【22】個,電子數【22】個。 (2) 一個水(H2O)分子中所含質子數為【10】個,中子數【8】個,電子【10】個。 【解析】:碳:質子數=6 中子數=12-6=6 電子數=質子數=6
◎已知甲、乙、丙三種原子的質子數與中子數如右表,則: (1) 那一個原子的質量最大?【丙】。 (2) 那些原子的化學性質相同?【甲丙】。 (3) 甲、乙是否同一種元素?【否】。甲、丙是否同一種元素?【是】。 【解析】:甲質量數=32+14=46 乙質量數=30+14=44 丙質量數=32+16=48 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
一、選擇題: (
)1.
關於化學變化發生的前後,下列敘述何者正確? 【答案】:【B】 【解析】:化學反應前後,分子的總數(總體積)可能保持不變,但是反應前後的總質量則一定不變。 (
)2.
蠟燭燃燒產生二氧化碳和水,下列有關此反應敘述何者正確? 【答案】:【C】 【解析】:蠟燭成份含C、H元素,燃燒產生CO2及H2O,依道耳吞原子說,反應前後原子質量、種類、個數保持不變,僅原子排列改變。 (
)3.
物質發生化學變化前後: 【答案】:【B】 【解析】:物質發生化學變化前後,原子的質量、種類、個數保持不變,僅 (丙)原子的組合發生改變, (丁)形成新的分子,但反應前後遵守 (戊)質量守恆定律。 (
)4.
【答案】:【B】 【解析】:化合物為不同粒子依特定的比例相結合。 ( )5.
承上題,A、B、C、D各物質,組成粒子如圖,屬於元素者為何? 【答案】:【C】 【解析】:元素是由同一種粒子結合而成。 (
)6.
蠟燭燃燒生成二氧化碳和水蒸氣,這可說明蠟燭不含下列何物 【答案】:【A】 【解析】:蠟燭燃燒生成水蒸氣和二氧化碳,但沒有產生含氮的化合物;因此原物質內不會有氮元素。 (
)7.
在一般的化學反應中,可能改變的是下列何項? 【答案】:【B】 【解析】:一般的化學反應因為會產生化學變化,可能改變的是分子的種類。 (
)8.
1937年德國興登堡號飛船,橫越大西洋前往美國時,即將抵達終點時,突然在空中起火爆炸,造成重大傷亡,是因此氣船充滿何種氣體? 【答案】:【C】 【解析】:氫氣具有可燃性,只要一點火花,容易和氧氣結合產生水,造成激烈的爆炸。 (
)9.
一個氮分子含有幾個原子? 【答案】:【B】 【解析】:氮氣分子是雙原子分子,分子式為N2。 (
)10. 碳酸鈉中的鈉原子和氫氧化鈉中的鈉原子,其質量大小為何? 【答案】:【C】 【解析】:依道耳吞的原子說,相同的原子其質量和大小都相同,和來源無關。 (
)11. 鑽石、石墨和芙,均是由碳原子所構成,但它們的性質差異極大,主要原因是何者的不同? 【答案】:【C】 【解析】:鑽石、石墨和芙,均是由碳原子所構成,稱為同素異性體。 (
)12. 下列那兩種氣體混合有爆炸危險? 【答案】:【A】 【解析】:氫氣具有可燃性,和氧氣點火燃燒產生激烈的反應。 (
)13. 氫+氧→水,下列敘述何者錯誤? 【答案】:【C】 【解析】:氫氣H2、氧氣O2,都是由雙原子組成的元素物質。
( )14.
甲、乙、丙、丁四種物質,組成如圖,其中○、●表示兩種不同的原子。下列敘述何者正確? 【答案】:【D】 【解析】:甲乙皆為單一的一種原子所組成,所以都是元素; (
)15. 不論何種物質,都是由極小的原子組成的,這種看法是於1808年提出,叫做什麼? 【答案】:【D】 【解析】:道耳吞的原子說主張,所有物質都是由微小的粒子所組成,這種粒子稱為原子。 ( )16.
若●代表氬原子,則下列模型何者可表示氬氣? 【答案】:【A】 【解析】:氬氣是單原子分子,因活性小,不易形成化合物,在自然界都是單獨存在,化學式為Ar,只有一顆●原子,即成為獨立的物質。 (
)17. 下列那些物質是由「分子」組成的? 【答案】:【B】 【解析】:在自然界能存在,且具有物質特性的粒子,稱為分子。 (
)18. 物質發生化學變化時,原子重新排列生成新的物質,但各原子的重量為何? 【答案】:【A】 【解析】:依道耳吞的原子說,進行化學反應時,原子會重新排列,組成新的粒子,但是各原子的質量、種類和個數則始終保持不變,亦即原子不生不滅。 (
)19. 下列敘述何者正確? 【答案】:【D】 【解析】:(A) 所有物質都是由原子所組成,相同的原子有相同的性質,不同的原子有不同的性質。 (
)20. 蠟燭燃燒時,與空氣中的氧氣反應,生成二氧化碳和水,已知氧氣中含有氧原子,二氧化碳中含有氧和碳兩種原子,水中含有氫及氧兩種原子,由此可確定蠟燭中至少含有那幾種原子? 【答案】:【A】 【解析】:蠟燭中含碳原子(C),和空氣中的氧結合成為二氧化碳分子; (
)21. 下列那一項敘述不是「道耳吞原子說」的內容? 【答案】:【C】 【解析】:道耳吞的原子說只提及原子是組成物質的最小粒子,尚未知原子內尚有電子、質子和中子。 ( )22.
「 【答案】:【B】 【解析】:化合物具有2種以上不同的原子,因此(B)有2種不同粒子,為化合物。 (
)23. 植物行光合作用發生化學反應時,各化合物之間的敘述,下列選項何者正確? 【答案】:【D】 【解析】:植物行光合作用發生化學反應,反應式為: (
)24. 於下列反應中:碳酸鈣+鹽酸→氯化鈣+水+二氧化碳,若反應物中有鈣原子30個,則生成物中有多少個鈣原子? 【答案】:【B】 【解析】:化學反應前後原子的質量種類個數保持不變,所以在反應前反應物有鈣原子30個,反應後的生成物有鈣原子也是30個。 ( )25.
某化學反應如下:則產物空格,應填入下列何者? 【答案】:【B】 【解析】:反應前方程式左邊有6個 (
)26. 二十世紀初,由實驗結果推斷出,原子是由帶負電的電子環繞帶正電的原子核構成之原子模型的科學家為 【答案】:【B】 【解析】:二十世紀初,拉塞福發現原子核,並提出行星模型,認為原子是由帶負電的電子環繞帶正電的原子核構成。 (
)27. 【答案】:【C】 【解析】:甲、已都只含一種粒子,因此甲乙都是元素,丙含2種不同的粒子,因此丙為化合物。 (
)28. 依拉塞福的原子模型,下列敘述何者錯誤? 【答案】:【B】 【解析】:中性原子內部的電子(負電荷)和中心的質子(正電荷)數目應相等。 (
)29. 關於原子結構,何者正確? 【答案】:【B】 【解析】:(A) 電子在原子的外圍環繞,質子和中子則集中在原子的中心。 (
)30. 下列粒子的大小,何者由小而大排列? 【答案】:【A】 【解析】:晶體是由許多的分子依特定的排列方式堆積而成,而分子是由不同的原子依一定的比例所組成,而原子內部含有電子。 (
)31. 質子、中子、電子最先被發現者為 【答案】:【A】 【解析】:電子帶負電,在原子外圍,最先為湯木生所發現。 (
)32. 下列何者為最先被發現電荷的最小單位? 【答案】:【A】 【解析】:電子帶負電,為自然界最小的基本粒子,在原子的外圍,最先為湯木生所發現。 (
)33. 下列有關原子結構的敘述,那一項錯誤? 【答案】:【D】 【解析】:中性原子失去電子後,質子數會比電子數多,因此原子會帶正電,成為陽離子。 (
)34. 鋁質子數為13,下列敘述何者錯誤? 【答案】:【A】 【解析】:鋁質子數為13,在原子核內含有13個質子,而在原子核的外圍有13個電子環繞。 (
)35. 有關原子結構的敘述,下列何者錯誤? 【答案】:【D】 【解析】:(D)錯誤,原子核是由帶正電的質子和不帶電的中子所構成,點子則是在原子的外圍。。 (
)36. 下列有關原子結構的敘述,何者正確? 【答案】:【C】 【解析】:(A)大多數原子核由質子和中子所構成; (
)37. 下列有關原子結構的敘述,何者正確? 【答案】:【A】 【解析】:(A) 原子包含質子中子和電子,原子質量則是所有粒子的質量總和。 (
)38. 原子呈電中性的原因是 【答案】:【B】 【解析】:原子呈電中性的原因是,原子核內的質子數目和核外的電子數目相等。 (
)39. 組成原子的三種基本微粒子是電子、質子和中子,若某原子核含X個質子和Y個中子,核外軌道含Z個電子,則下列何者對任何元素的原子皆正確? 【答案】:【C】 【解析】:原子內部的質量數=質子數(X)+中子數(Y)。 (
)40. 下列有關原子結構的敘述,何者錯誤? 【答案】:【C】 【解析】:(C)錯誤,原子核本身是由帶正電的質子和不帶電的中子所組成。
(
)41. 甲、乙、丙、丁四種原子,其質子數、中子數及質量如右表,則下列那一組原子具有相同的性質? 【答案】:【D】 【解析】:原子的性質由質子數目決定,因此原子具有相同的性質必須原子核內的質子數目相等,所以丙和丁的質子數目相等,皆為25,表示都是相同元素。 (
)42. 有關原子結構的敘述,何者錯誤? 【答案】:【D】 【解析】:(D)原子核內質子數目必等於原子和外電子數相等,但中子數目則不一定會相等。 (
)43. 原子中易以轉移的粒子為 【答案】:【C】 【解析】:原子外層的電子,繞著原子和旋轉,最容易脫離原子的束縛,而離開原子。 (
)44. 一個原子會帶負電,是由於下列何種原因? 【答案】:【C】 【解析】:原子帶負電,是因為原子獲得電子,使得原子內部的電子數目增加,因此負電荷比正電荷多,才因此帶負電。 (
)45. 有關原子的敘述何者錯誤? 【答案】:【D】 【解析】: (
)46. 質子、中子、電子三種粒子質量的大小關係為何? 【答案】:【A】 【解析】:中子的質量最大,比質子質量略大,質子質量約等於中子質量,而遠大於電子質量;因此中子質量=質子質量>電子質量。 (
)47. 一個原子的質量約為 【答案】:【A】 【解析】:由於電子的質量太輕,因此經常經電子的質量忽略,計算原子的質量,經常僅算質子和中子的質量和;一個原子的質量大約等於質子質量和中子質量的總和。 (
)48. 原子的性質,隨著下列何種粒子的數目之不同而不同? 【答案】:【A】 【解析】:原子的性質由質子的個數決定,質子數相同,代表同一種原子,質子數不同則表示為不同的原子,因此便有不同的化學性質。 (
)49. 已知氫和氧原子所含的質子各為1,和8,若一個水分子由一個氧原子和二個氫原子組成,則一個水分子所含的質子數為 【答案】:【B】 【解析】:水分子的化學式為H2O,包含2個氫原子和1個氧原子。 (
)50. 氯原子獲得一個電子而帶負電(寫成Cl-),此時具有電子數為18,則一個中性的氯原子含有質子 【答案】:【B】 【解析】:Cl-有18個電子,因此電子多1個,所以質子比電子少1個, (
)51. 關於原子結構的敘述,何者錯誤? 【答案】:【B】 【解析】:原子核僅由質子和中子所組成,電子在原子核外,不在原子核內。 (
)52. 毛皮摩擦塑膠棒,毛皮帶正電,則 【答案】:【C】 【解析】:毛皮和塑膠棒摩擦,毛皮因為失去電子,即電子由毛皮轉移至塑膠棒,所以毛皮的電子減少,因此帶正電,而塑膠棒則因得到電子,因此電子數目增加,因此帶負電。 (
)53. 右表中,那兩欄有錯誤?
【解析】:電子帶負電,中子不帶電;電子在原子和外圍,而質子則在原子核中央,因此(乙)(丁)為錯誤。 (
)54. 原子帶正電,是由於下列何種原因造成? 【答案】:【C】 【解析】:原子帶正電,是由於電子轉移,原子失去了電子,因此質子數目比電子數目多,所以才會帶正電。 (
)55. 與絲絹摩擦過的玻璃棒帶正電,此時玻璃棒上的電子總數與質子總數相較之下為 【答案】:【A】 【解析】:絲絹和玻璃棒摩擦,使得絲絹帶負電,玻璃棒帶正電,此時玻璃棒的電子數目減少,因此質子數目>電子數目。 (
)56. 【答案】:【D】 【解析】:化學性質相同,必須有相同數目的質子,因此P需相同,所以僅有乙和丁質子數皆為25。 (
)57. 氧原子與氯原子化學性質不同,主要由於 【答案】:【A】 【解析】:不同的原子由於質子數目不同,因此性質不相同,所以氧原子與綠原子為不同原子,有不同的質子數目。 (
)58. 硫酸分子的化學式為H2SO4,根據此化學式,則下列哪一項推論是錯誤的? 【答案】:【D】 【解析】:H2SO4包含H、S、O三種原子,而共有2個H原子、1個S原子、4個O原子,共7個原子;其中O原子最多。 (
)59. 有個比喻「原子核相對於整個原子,相當於一隻蒼蠅在一個大教堂」關於這句話的相關敘述,下列何者錯誤? 【答案】:【B】 【解析】:原子內部的質量集中在中心的原子核,而原子核的體積極小,可以比喻成大教堂內的一隻蒼蠅,或是足球場中央的1個銅板。 ( )60.
下列哪一項敘述不是「道耳吞原子說」的內容? 【答案】:【A】 【解析】:所有的原子外圍由電子圍繞,因此所有的原子形狀皆為球形,不同的原子可能半徑大小、質量多少不相同,但是原子的形狀應相同。 (
)61. 有關拉塞福提出的模型,下列敘述何者正確? 【答案】:【B】 【解析】:依據拉塞福的原子模型,電子在原子的外圍,繞著中心的原子核旋轉,電子旋轉的半徑即為原子的大小。 ( )62.
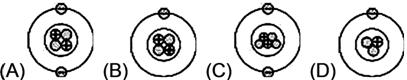
已知He的原子序=2,原子量=4,則He的結構圖,哪一個圖比較合理? 【答案】:【A】 【解析】:氦原子序2,原子量4,在中心有2個帶正電的質子,2個不帶電的中子,在外圍有2個帶負電的電子。 (
)63. 原子電中性表示什麼? 【答案】:【A】 【解析】:原子電中性表示在原子內部正電荷的質子數目等於負電荷的電子數目,因此必須質子數=電子數。 ( )64.
有關分子式的敘述,下列何者錯誤? 【答案】:【B】 【解析】:化學式包含分子式、示性式、結構式、簡式等,分子式為化學式表示的其中一種方法。 ( )65.
某中性原子Q的陰離子Q2-包含的電子數、中子數分別為36及34。則此中性原子所含之質子數x、電子數y、質量數z分別為何? 【答案】:【C】 【解析】:Q2-包含的電子數、中子數分別為36及34,表示原子包含電子數目36個,但因為”2-”,因此電子多2個,所以質子數目僅有36-2=34個質子。 ( )66.
下列哪一個示意圖比較接近拉塞福所提出的原子模型? 【答案】:【C】 【解析】:拉塞福的原子模型接近行星模型,假設電子在原子的外圍,繞著原子核旋轉,原子核內部有帶正電的質子和不帶電的中子,體積極小,但質量很大。 ( )67.
下列有關粒子特性的敘述,何者正確? 【答案】:【C】 【解析】:(A)質子帶正電; (B)不同種類的原子依一定的比例,所結合而成的是化合物; (
)68. 下列哪一原子的原子核中沒有中子的存在? 【答案】:【A】 【解析】:清原子序為1,質量數為1,僅有1個質子,在原子核內部無中子。 (
)69. 在皇宮的樑柱上貼了一層金箔,若以放大鏡仔細觀察,為何看不見金原子呢? 【答案】:【C】 【解析】:金屬是由原子堆積而成,但是原子的體積極小,以肉眼無法觀測,一般倍數的顯微鏡也無法觀測其存在。 ( )70.
下列的原子模型中何者不是同一元素? 【答案】:【D】 【解析】:(A)含2個質子、(B)含2個質子、(C)含有2個質子、(D)則僅有1個質子,因此(D)與其他元素不相同。 ( )71.
【答案】:【A】 【解析】: (
)72. 我們所定義的原子序,主要是以何者的數量作為判斷標準? 【答案】:【B】 【解析】:原子序為週期表內的原子排列順序,是依據質子數目排列。 (
)73. 組成原子的三種基本微粒是電子、質子和中子,若某中性原子原子核含X個質子和Y個中子,核外軌道含Z個電子,則下列何者對任何元素皆正確? 【答案】:【C】 【解析】:中性的原子內部,必定遵守質子數=電子數,因此X=Z; (
)74. 已知鈉的原子序為11,下列敘述何者錯誤? 【答案】:【B】 【解析】:鈉的原子序為11,表示原子核內部有11個質子,而原子核外則有11個電子;但是原子鈉大約等於質量數=質子數+中子數,題目未提及中子數,因此質量數無法判斷,但質量數必定大於11。 (
)75. 下列有關原子的模型各項敘述,何者比較符合現今已知原子內各種粒子的分布狀況? 【答案】:【C】 【解析】:以「行星繞日」的模型解釋電子繞原子核的現象,比較接近真實的原子內部;其中電子如同行星班,在外圍軌道繞著原子核旋轉,而原子核帶正電,和電子間以靜電力相吸引,原子核如同太陽系中的太陽一般,具有很小的體積,但是很大的質量。 ( )76.
哪一個可能是二氧化碳的分子模型圖? 【答案】:【C】 【解析】:二氧化氮的化學式為CO2,有1個碳原子,2個氧原子,因此以黑色表示C原子,白色表示O原子。 (
)77. 下列有關原子結構的敘述,何者正確? 【答案】:【A】 【解析】:(A) 電子的質量大約只有質子的1/1840倍,所以電子極輕,原子的質量幾乎集中在原子核內。 (
)78. 【答案】:【B】 【解析】:化合物包含2種以上的粒子所結合而成,因此圖中 (
)79. 下列關於各種物質的化學式的寫法,何者正確? 【答案】:【B】 【解析】:(A)氧化鈣:CaO (B)硫酸鈉:Na2SO4 (
)80. 有關原子結構的敘述,下列何者正確? 【答案】:【C】 【解析】:(A) 原子可分為原子核及外圍帶負電的電子; ( (
)81. 甲.湯木生發現電子;乙.道耳吞提出原子說;丙.拉塞福提出原子模型;丁.質子與中子被發現。關於以上原子結構相關的發現跟理論,依其提出的先後順序排列為何? 【答案】:【C】 【解析】:乙.19世紀初(1807年)道耳吞提出原子說,當時還不知原子可以再分割; (
)82. 下列有關道耳吞原子說的敘述,何者錯誤? 【答案】:【D】 【解析】:(D) 化學反應是原子的重新排列,反應前、後,原子的質量及種類、個數都不會改變。 (
)83. 原子的體積主要由下列何者決定? 【答案】:【B】 【解析】:原子的體積決定於電子繞原子核的空間大小。 (
)84. 今天所謂的真理,或許在下個世紀就會被淘汰,但是每個創新都必須奠基在舊有知識的基礎,因此,對一位研究科學的學者而言,科學的發展史也是相當重要的一環。請根據提出時間的先後,將甲、乙、丙三項事實依序排列? 【答案】:【D】 【解析】:甲.道耳吞提出原子說
丙.湯木生發現電子
乙.拉塞福提出原子模型。 (
)85. 原子的質量主要取決於何者? 【答案】:【B】 【解析】:質量數=質子數+中子數 (
)86. 有關原子結構的敘述,下列何者正確? 【答案】:【C】 【解析】:(A)原子核內質子數必須與核外電子數相等,原子才會保持電中性 (B)質子與中子的質量數大約等於原子的總質量 (C)當失去原子核外的電子時,整個原子將帶正電 (D)原子核內中子數與質子數不一定會相等。 (
)87. 【答案】:【B】 【解析】:如圖,原子核內有2個正電的質子,2個不帶電的中子,2個帶負電的電子。
(
)88. 如圖為一原子的元素符號,則有關此元素符號的敘述,下列何者正確? 【答案】:【B】 【解析】:Al為鋁原子,有13個質子,質量數=質子數+中子數=27, (
)89. 甲. 原子為組成所有物質的最小粒子; 【答案】:【A】 【解析】:道耳吞的原子說主張: (
)90. 有關原子結構的敘述,下列何者正確? 【答案】:【C】 【解析】:原子核內的質子須等於核外的電子,原子核才能保持電中性。 (
)91. 有關圖中氯化鈉的敘述,下列何者錯誤? 【答案】:【C】 【解析】:晶體由許多分子堆積而成;氯化鈉為一個鈉原子和一個氯原子的組合,化學式為NaCl,俗稱食鹽。 (
)92. 【答案】:【D】 【解析】:質量數=質子數+中子數; (
)93. 以下列出了四種常見物質的組成原子與分子式,請問哪一個選項是錯誤的? 【答案】:【C】 【解析】:二氧化硫的化學式為SO2。 (
)94. 下列有關原子內各項基本例子的敘述,何者正確? 【答案】:【B】 【解析】:原子內含有質子中子電子等基本粒子,故原子不再是最小的單位; ( )95.
原子是由中子、質子與電子三種基本粒子所組成。若以○、♁和●分別代表中子、質子與電子,則下列何者為 【答案】:【A】 【解析】: ( )96.
【答案】:【B】 【解析】:鈉原子、氯原子皆為電中性,質子數=原子序=電子數; ( )97.
下列關於氫原子( 【答案】:【C】 【解析】:氫原子序為1,質量數為1,氫原子內含1個質子,核外有1個電子,沒有中子。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
二、填充題: 1. 物質由粒子組成,一般金屬都是由【無數】個原子的分子組成的。 2. 一切物質都是由微小的粒子所組成,這些粒子叫做【原子】。 3. 不同的元素之原子,其【質量】及【大小】都不相同。 4. 【元素】的分子由相同的原子構成,【化合物】的分子是由不同的原子構成。 5. 道耳吞原子說認為『一切物質都是由稱為原子的微小粒子所組成』,以現代科學觀點而言,宜修訂為『一切物質都是由稱為原子的微小粒子所構成的【分子】所組成』較合適。 6. 道耳吞原子說認為:相同元素的原子,其原子質量【相同】,不同元素的原子,其原子質量【不同】。 7. 道耳吞原子說認為:相同元素的原子其原子大小【相同】,不同元素的原子,其原子大小【不同】。 8. 空氣中的氮是以由【2】個氮原子組成的【分子】型態存在。 9. 一個二氧化碳分子是由【2】個氧原子與【1】個碳原子所組成的。 10. 所謂化學反應,其實是原子間以【新的方式】結合成另一種物質的反應。 11. 化學反應前後,原子的質量、原子的特性、原子的種類三者之中何者產生改變?【皆不變】。 12. 化學反應前後,原子間的排列方式,原子的質量、原子的特性、原子的種類四者之中,產生改變的是【排列方式】。 13. 灌滿氫氣的氣球接觸到火焰會有爆炸的危險,是因為氫氣和空氣中的【氧氣】產生劇烈作用所致。 14. 氧原子的體積較氫原子【大】,氧原子的質量較氫原子【大】。 15. 一個氧分子由【2】個氧原子組成,一個氬分子由【1】個氬原子組成。 16. 下列各物質: 17. 原子序 19、質量數 39 的鉀原子中,含電子【19】個、質子【19】個、中子【20】個, 18. 試完成下列反應:氫+氧è【水】。 19. 依據原子結構模型回答下列問題: ( )1. 在原子中帶負電的粒子是 ( )1. 化學反應時能從一原子轉移至另一原子的是 ( )1. 下列粒子中,質量最大的是 ( )1. 原子核內所含的粒子是 20. 完成下表中空格:
|

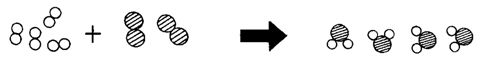





















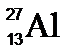





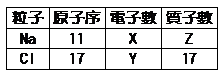 下表列出鈉原子
下表列出鈉原子