|
|
|
(一) 反應速率(R): A、
日常生活中,有些反應很快,有些反應很慢; B、
單位時間內反應物的消耗量愈大,反應速率愈【大】,所需的時間愈【短】。 C、
D、
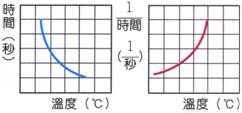
反應速率(R)和時間成【反】比( 和時間的倒數成【正】比 ) E、
反應速率的測量,常選擇易觀察的,如:有色物質、生成沉澱、氣體變化……等。 F、
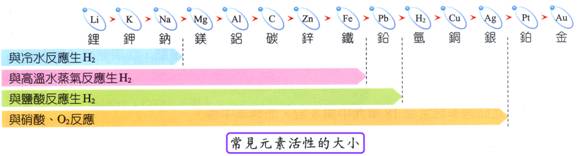
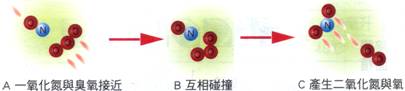
影響反應速率的因素: (1) 物質本性:物質的活性愈大,反應速率亦將愈大。 (2) 表面積:表面積愈大,反應速率愈快。 (3) 濃度:濃度愈大,反應速率愈快。 (4) 溫度:溫度愈高,反應速率愈大。 (5) 催化劑:加入催化劑後,可影響反應的快慢。 G、 H、 碰撞學說: (1) 物質皆由【粒子】組成。 (2) 化學反應是由於【粒子】相互碰撞,產生新的物質。 (3) 粒子碰撞時,不一定產生反應;但要產生反應,則必須產生【碰撞】。 (4) 參加碰撞的粒子必須具有適當的【能量】,才能產生有效的碰撞。 (5) 有效的碰撞次數愈多,產生反應的機會愈【大】。
(二) 表面積的影響 : [例] 若一正立方體,邊長4㎝,則總表面積為【96】㎝2。
若將此正立方體的長寬高皆四等分,則每一小塊的表面積為【6】㎝2; 小立方體的數目共有【64】塊;
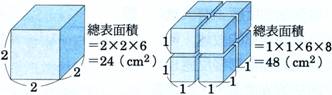
切割後的總表面積為【384】㎝2; [例] 若一正立方體,邊長2㎝,則總表面積為【24】㎝2。
若將此正立方體的長寬高皆二等分,則每一小塊的表面積為【6】㎝2;
小立方體的數目共有【8】塊;
切割後的總表面積為【48】㎝2;
【結論】一物質切割為n等分後,總表面積將增為【n】倍。 A、 依【碰撞】學說解釋: B、 利用碳酸鈣和稀鹽酸的反應解釋反應速率: CaCO3 + 2HCl ﺚCaCl2
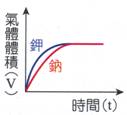
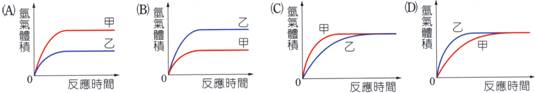
+ H2O + CO2 [例] 甲:大理石塊 、 乙:大理石顆粒、 丙:大理石粉末、 [例] (甲)取10克的鋅塊,加入1M、500mL鹽酸,(乙)取10克的鋅粉,加入1M、500mL鹽酸,則產生氫氣的體積和反應速率的圖形,下列何者正確? 同上題選項,若(乙)改成取20克的鋅粉,加入1M、500mL鹽酸,則產生氫氣的體積和反應速 率的圖形,則圖形該為何圖? [解析]:產量和反應物數量(莫耳數)有關,反應速率和顆粒大小有關,顆粒愈小,反應速率愈快。 (三) 濃度的影響: A、 將藥品配成溶液後,由於粒子的移動性增【大】(【自由度】增加),因此【碰撞】機會增多,反應速率增大。 B、 一般而言,【氣體】的自由度最大,最容易移動,因此反應速率最快。 C、 反應速率:氣體>溶液>粉末>顆粒>塊狀固體。 [例]: 甲:大理石顆粒、0.2 MHCl 乙:大理石顆粒、 0.5 MHCl 反應速率的大小,由快至慢為:【丙>乙>甲】。 丙:大理石顆粒、1.0 MHCl
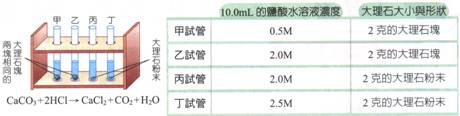
[例]: 甲:大理石塊、 0.5 MHCl 乙:大理石塊、 2.0 MHCl 丙:大理石粉末、 2.0 MHCl 丁:大理石粉末、 2.5 MHCl 則反應速率的大小,由快至慢為【丁>丙>乙>甲】。 |
|
一、選擇題: ( )1.我們在博物館看到的古文物中,通常銅器多於鐵器;但人類利用鐵器卻較銅器晚。會有如此現象,最可能與銅和鐵的哪些性質有關? 【答案】:【D】 【解析】:由於銅的活性比鐵的活性小,因此銅比鐵不容易生鏽,因此雖然鐵器較晚出現,但是因為活性大不容易保存,因此銅器反而多於鐵器。 ( )2.一般化學反應若希望有較快的反應速率,可將溫度如何改變? 【答案】:【B】 【解析】:若希望有較快的反應速率,最有效的方法是提高溫度,溫度高,則能量大,具有高能量的分子便愈多,於是反應時產生的有效碰撞愈多。反應速率也愈快。 ( )3. 【答案】:【C】 【解析】:貝殼重量皆相同(皆為 ( )4. 【答案】:【C】 【解析】:欲探討的變因,為改變的變因,亦稱為操縱變因,此時其他的變因,則須保持固定不變,稱為控制變因。 ( )5.夢含分別對鈉、金、鐵三種不同的金屬做不同的觀察與實驗,其結果為:鈉必須存放在石油中,避免在空氣中快速氧化;金放在火中冶煉一段時間,仍會保持原有的金屬光澤;鐵放在空氣中一段時間後,外表會覆蓋一層鐵鏽;根據這三種金屬不同的反應速率,判斷它們的活性大小為何? 【答案】:【C】 【解析】:鈉活性最大,必須存放在石油中,避免在空氣中快速氧化;金活性最小,放在火中冶煉一段時間,仍會保持原有的金屬光澤;鐵的活性介於鈉與金之間,因此三者活性大小:鈉>鐵>金。 ( )6.CaCO 【答案】:【C】 【解析】:容器的形狀和反應速率無關。 ( )7.艾庭利用貝殼與鹽酸來進行二氧化碳製造的實驗。然而她嫌反應速度太慢,於是將貝殼敲碎。請問此舉是利用何種原理讓反應速度變快? 【答案】:【A】 【解析】:將貝殼敲碎,可以增加接觸的總表面積,使得碰撞機會增加,反應速率加快。 ( )8.在「反應物表面積與反應速率」實驗中,觀察灰石與鹽酸反應後生成之何種產物產生速率來判斷反應速率? 【答案】:【B】 【解析】:灰石與鹽酸的反應: CaCO3+2HCl ﺙ CaCl2+H2O+CO2 ( )9.煮火鍋時,楓荃見媽媽買的火鍋肉片都是薄片狀,媽媽說:這樣比較容易煮熟。這原理與下列何者相近? 【答案】:【B】 【解析】:火鍋肉片都是薄片狀,可以藉著切片較薄,總表面積增加,反應速率較快,鐵粉在空氣中氧化,比鐵片的速率快,也是和鐵片的表面積有關。 ( )10. 艾樺見媽媽切菜,會把肉絲切的細細的放入鍋中,主要的原因是因為何種原因? 【答案】:【D】 【解析】:肉絲切細細的放入鍋中,因表面積增加,和熱水接觸面積增加,肉較容易煮熟。 ( )11. 下列有關化學反應速率的敘述,何者正確? 【答案】:【C】 【解析】:反應物的濃度越大,則其反應速率較快;酵素為生物體內的一種催化劑; ( )12. 下列何者不影響反應速率? 【答案】:【D】 【解析】:反應放熱多少和反應速率無關。 ( )13. 下列敘述何者正確? 【答案】:【B】 【解析】:反應速率的大小由化學方程式不法判斷,方程式只能表示反應的產物,無法表示反應的快慢時間。 ( )14. 以下何者和反應速率無關? 【答案】:【D】 【解析】:反應容器體積和反應速率無關。 ( )15. 關於催化劑下列何者錯誤? 【答案】:【D】 【解析】:催化劑可以改變反應速率;催化劑的質量在反應前後,不增加也不減少,因此不是反應物也不是生成物;生物體中含有很多或酵素可以當催化劑。 ( )16. 下列何者不影響反應速率? 【答案】:【D】 【解析】:容器的大小不影響反應速率。 ( )17. 為何埃及法老王的面具,選擇金作為材料? 【答案】:【A】 【解析】:金的活性小,化學性質安定不活潑,不容易變質損毀,因此可以長期保存。 ( )18. 將 【答案】:【C】 【解析】:甲試管與乙試管的鹽酸濃度都相同,皆為10%的鹽酸,因此相同的濃度,將有相同的反應速率,所以A、B的反應速率都一樣快。 ( )19. 【答案】:【D】 【解析】:溫度愈高反應速率快,因此 ( )20. 芸臻的爸爸去海邊釣魚,釣上來的漁穫放入帶來的大水桶中,如果爸爸想讓歆樺吃到比較新鮮的魚,他該如何處理呢?(假設魚釣上來後立刻死亡) 【答案】:【C】 【解析】:大水桶內加入一些碎冰塊,將魚塞入冰塊中,藉著碎冰塊和魚有較大面積的接觸,可以加強魚的低溫冷凍能力,獲得較新鮮的魚。 ( )21. 許多化學反應進行時需加入催化劑以增加反應速率,有關催化劑的敘述何者正確? 【答案】:【B】 【解析】:(A) 催化劑質量,在化學反應前後,不增加或減少,因此不是反應物,也不是生成物; ( )22. 化學反應的快慢會受某些因素的影響而改變,例如將鎂與鋁分別置入裝鹽酸的試管中,可以發現鎂帶與鹽酸的反應較為激烈,這最可能的原因為何? 【答案】:【B】 【解析】:鎂與鋁分別置入裝鹽酸的試管中,發現鎂的反應比鋁的反應快,是因為鎂的活性比鋁大,因此反應較迅速。 ( )23. 【答案】:【B】 【解析】: ( )24.
【答案】:【D】 【解析】:表格中,硫代硫酸鈉的濃度不一樣,一酸的濃度也不一樣,因此是哪一個因素的影響,無法判斷。 實驗的討論,一次只能改變一個變因,不能兩個因素都變化。
( )25. 宴會過後,往往會剩下一堆未吃完的菜,全部丟掉又太可惜,可是一次又吃不完。請問應該如何收藏這些剩菜,才不至浪費? 【答案】:【C】 【解析】: ( )26. 硫代硫酸鈉與鹽酸混合的反應中,將化學反應式平衡後,反應物與產物的係數總和為多少? 【答案】:【C】 【解析】: ( )27. 下列有關化學反應速率的敘述,何者錯誤? 【答案】:【D】 【解析】: ( )28. 人類唾液中含有澱粉,可以把澱粉分解為麥芽糖。這原理與下列何者較為相近? 【答案】:【D】 【解析】: ( )29. 【答案】:【D】 【解析】: ( )30. 為證明濃度變化對於反應速率有所影響,柔安設計了如下表的實驗。請問哪兩組實驗才能幫他達成她所要證明的事情? 【答案】:【B】 【解析】: ( )31. 有四種金屬的活性,其順序為X>Y>Z>W,請判斷下列哪一個金屬最容易與氧發生反應? 【答案】:【A】 【解析】: ( )32. 鋅比鐵活性大,但卻常見在鐵的外部鍍上一層鋅來防止鐵生鏽,這是為什麼呢? 【答案】:【B】 【解析】: ( )33. 古埃及文物中,法老王的金製面具經歷數千年,至今仍然色澤鮮豔。這與黃金的那項性質有關? 【答案】:【D】 【解析】: ( )34. 有關化學反應速率的敘述,下列何者錯誤? 【答案】:【C】 【解析】: ( )35. 在化學反應中,催化劑是屬於下列何者? 【答案】:【C】 【解析】: ( )36. 硫代硫酸鈉與鹽酸混合的實驗中,會遮住錐形瓶底部十字的主要產物是何者? 【答案】:【B】 【解析】: ( )37. 莉瑋取二支裝有10%鹽酸的試管,甲支置於 【答案】:【A】 【解析】: ( )38. 宜瑄想製造氧氣,她在 【答案】:【B】 【解析】:( ( )39. 下列何者反應速率最慢? 【答案】:【D】 【解析】: ( )40. (甲)鐘乳石之形成 (乙)璀璨的煙火爆炸 (丙)鐵生鏽 (丁)水的電解 以上化學反應的時間,依照反應所需時間由長到短排列的順序為何? 【答案】:【B】 【解析】:題目沒規定不能點火,因此(乙)點火瞬間反應,速率最快! ( )41. 以下關於反應速率的敘述,何者錯誤? 【答案】:【C】 【解析】: ( )42. 在「催化劑與反應速率」的實驗中,會在燒杯內加入一些二氧化錳,則下列敘述何者錯誤? 【答案】:【D】 【解析】: ( )43. 將鎂帶及鋁片加熱會發現,鎂帶可以燃燒,而鋁片卻不行,所以鎂帶可以當作製造仙女棒的材料之一。請問:會造成此一差異的原因為何? 【答案】:【B】 【解析】: ( )44. 下列何者不能促使反應速率加快? 【答案】:【B】 【解析】: (
)45. 若燒杯中有 【答案】:【B】 【解析】: (
)46. 下列情況何者反應速率最快? 【答案】:【D】 【解析】: (
)47. 下列何種反應因加入催化劑而加快反應速率? 【答案】:【B】 【解析】: (
)48. 大部分的加油站其油庫均建置在地底,其主要原因為何? 【答案】:【A】 【解析】: (
)49. 關於國慶日煙火的施放,下列敘述何者正確? 【答案】:【C】 【解析】: (
)50. 雅筑在 【答案】:【A】 【解析】: (
)51. 將鹽酸滴在貝殼上面,會產生氣泡,欲增加反應的速率,下列哪種方法較適當? 【答案】:【C】 【解析】: (
)52. 【答案】:【D】 【解析】: (
)53. 把馬鈴薯切成小塊再油炸,與整顆直接油炸,以反應速率而言,下列敘述何者正確? (A)前者較快熟,因為活性較大 (B)後者較快熟,因為活性較大 (C)前者較快熟,因為總表面積較大 (D)後者較快熟,因為總表面積較大 【答案】:【C】 【解析】: (
)54. 由碰撞學說知,欲使反應產生 【答案】:【A】 【解析】: (
)55. 下列有關鹽酸與碳酸鈣反應的敘述,何者正確? 【答案】:【D】 【解析】: (
)56. 下列為一定質量的貝殼與鹽酸的反應,則何組冒出氣泡最快? 【答案】:【D】 【解析】: (
)57. 某一立方體,邊長 【答案】:【A】 【解析】: (
)58. 宜蓁在煮火鍋時發現媽媽買的火鍋肉片通常都是薄片狀,媽媽說:「這樣比較容易煮熟。」請問這原理與下列何者較相近? 【答案】:【D】 【解析】: (
)59. 【答案】:【A】 【解析】: (
)60. 列為一定量的貝殼與鹽酸的反應,則何組冒出氣泡的速率最快? 【答案】:【D】 【解析】: (
)61. 燃燒紙張時,將紙張逐一的放入火爐中會比整疊放入火爐中,燃燒得更旺盛,下列何者為造成此現象的主要原因? 【答案】:【D】 【解析】: (
)62. 打開食品或藥品的包裝,經常會看到一些小藥包,可被磁鐵吸住,它的成分是鐵粉,為何不用鐵片或鐵塊? 【答案】:【C】 【解析】: (
)63. 甲試管裝 【答案】:【A】 【解析】: (
)64. 下列敘述何項錯誤? 【答案】:【C】 【解析】: (
)65. 化學實驗室中,常將許多固態的化學藥品,先配成一定濃度的溶液後才使用。下列敘述何者錯誤? 【答案】:【C】 【解析】: (
)66. 奶奶燒香拜拜,燒紙錢時,將紙錢攤開燒會比整疊燒得快,這是合乎影響反應速率的變因中之哪一項因素? 【答案】:【B】 【解析】: (
)67. 【答案】:【A】 【解析】: (
)68. 【答案】:【A】 【解析】: (
)69. 【答案】:【C】 【解析】: (
)70. 生產大量乾燥粉狀可燃物的場所,常有爆炸的危險,其理由與下列何因素有關? 【答案】:【B】 【解析】: (
)71. 甲、乙、丙三試管中所含鹽酸溶液的pH值依次為3、6、4,三試管中各加入等量且顆粒大小相等的貝殼,其反應速率由大而小依序為 【答案】:【A】 【解析】: (
)72. 營火晚會時,營火所用的木頭排列如右圖,這樣的排列方式,除了考慮不容易坍塌之外,是為了下列哪一項原因? 【答案】:【C】 【解析】: (
)73. 爆竹工廠儲存大量乾燥粉狀可燃物,常有爆炸的危險,其理由與下列何因素有關? 【答案】:【B】 【解析】: (
)74. 點燃煤塊很困難,但點燃等質量的煤粉卻很容易,其原因為何? 【答案】:【B】 【解析】: (
)75. 將 【答案】:【A】 【解析】: (
)76. 昱萱生病吃藥時,將藥丸研磨成粉末再以開水服用,這是合乎影響反應速率的變因中之哪一項因素? 【答案】:【B】 【解析】: (
)77. 有關粒子碰撞與化學反應之間的敘述,何者錯誤? 【答案】:【A】 【解析】: (
)78. 下列何種操作無法使反應速率變快? 【答案】:【C】 【解析】: (
)79. 下列哪一種反應,其反應速率最快? 【答案】:【A】 【解析】: (
)80. 下列為一定質量的大理石與鹽酸進行反應,則哪一組冒出氣泡的速率最慢? 【答案】:【C】 【解析】: (
)81. 【答案】:【C】 【解析】:大理石+稀鹽酸→氯化鈣+水+二氧化碳 (
)82. 已知表面積增加一倍,反應速率增加一倍,某一立方體,邊長 【答案】:【A】 【解析】: (
)83. 以碰撞學說的觀點,反應物粒子互相碰撞的機會愈多,反應速率愈快。則下列何項操作無法使反應速率變快? 【答案】:【C】 【解析】: (
)84. 下列實驗中何者反應速率最快? 【答案】:【A】 【解析】: (
)85. 【答案】:【D】 【解析】: (
)86. 如圖,甲、乙兩燒杯中的大理石塊,與濃度相同的鹽酸完全接觸反應,則其反應速率的關係為何? 【答案】:【A】 【解析】: (
)87. 下列何者是因為反應物的接觸面積大,而使反應速率加快的實例? 【答案】:【D】 【解析】: (
)88. 反應速率之說明正確的是 【答案】:【B】 【解析】:(A) 固體配成溶液反應速率會變快。 (
)89. 取乾淨試管甲與乙,在甲試管中加入蒸餾水 【答案】:【C】 【解析】: (
)90. 下列敘述何者與總表面積影響反應速率無關? 【答案】:【D】 【解析】: (
)91. 設煤炭的燃燒速率與接觸空氣的面積成正比,則一正方體的煤炭分割成八塊大小相同的小正方體後,其燃燒速率是原來的 【答案】:【A】 【解析】: (
)92. 當大量的煤灰瀰漫在乾燥空氣的場所中,常會有爆炸的危險性,其理由與下列何種因素有關? 【答案】:【B】 【解析】: (
)93. 鐵器比銅器容易氧化,這是哪一個反應速率的變因所造成的結果? 【答案】:【B】 【解析】: (
)94. 【答案】:【C】 【解析】: (
)95. 氮與氫合成氨的過程中,改變下列哪一項因素,不能增加其反應速率? 【答案】:【D】 【解析】: (
)96. 【答案】:【C】 【解析】: (
)97. 映含將鐵釘分別置於二試管中(如右圖),放置幾天後,發現B試管中鐵釘生鏽較多;在這實驗中影響生鏽速率的因素是 【答案】:【B】 【解析】: (
)98. 依照碰撞學說,欲使反應速率加快,哪一種方法既可提升粒子的能量,又可增加碰撞的機率? 【答案】:【A】 【解析】: |
|
二、填充題: 1. 下列各項何者可求出反應速率? 2. 物質發生反應時,在一定時間內,反應物減少的量愈多,則反應速率【愈快】;所生成的產物量減少,則反應速率【變慢】。 3. 粒子互相碰撞在一起時,才能產生新的粒子而形成新的化合物,稱為【碰撞】學說。 4. 影響反應速率的主要因素有: 5. 物質分割愈細,它的【總表面積】就愈大,因此反應速率也就愈大。 6. (甲)放入大片鎂帶於 7. A、B、C三試管中所含鹽酸溶液PH值依次為2、5、3,三試管中各加入等重且顆粒大小相等的貝殼其反應速率由大而小依次為【A>C>B】。 8.
A、B兩試管各放入 9. A試管中裝 10. A 試管中裝 11.
( )1.
何者為此實驗的反應式?【A】 ( )2.
在錐形瓶內加入一些二氧化錳來製備氧氣,有關此敘述,下列何者錯誤?【ACD】 12.
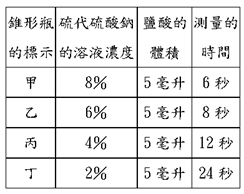
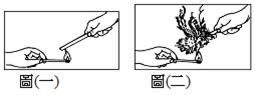
陳妤為了要瞭解反應物濃度與反應速率的關係,於是利用不同濃度的硫代硫酸鈉與鹽酸混合的反應,利用產生之黃色沈澱物將瓶底十字標記遮住的時間來判斷反應速率的快慢。 (1)
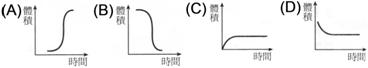
若以硫代硫酸鈉的剩餘體積為縱座標,時間為橫座標,其圖型為何?【D】 (2)
反應完成時,可知溶液酸鹼性為 (A)酸性 (B)鹼性 (C)中性 (D)不一定。【A】。 13.
耶誕節時,玟潔和同學在老師的帶領下舉辦營火晚會,搭營火 (1)
生火時,木材劈得較細較薄,且堆得寬寬鬆鬆,主要原因可能為 (2)
仙女棒燃燒時發出美麗的光芒,有關仙女棒燃燒的敘述,何者有誤? (3)
砂子灑在營火上,可以熄滅營火的主要原因為何? |