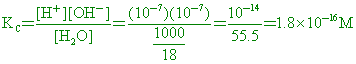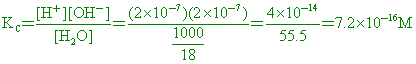|
(
)1. 在25 【答案】:(B) 【解析】:1公升的水質量1000克,水的莫耳數= (
)2. 10- 【答案】:(C) 【解析】:H+莫耳數為10-8莫耳,在常溫下的水容易形成鹽酸水溶液,能完全解離,但不會成為鹼性,僅是很弱的酸性接近中性,因此pH值接近7,但會小於7。 (
)3. 下列何反應,可視為中和反應? 【答案】:(D) 【解析】:強酸和強鹼中和的離子方程式,為H++OH-→H2O, (
)4. 下列何者是酸鹼中和反應? 【答案】:(B) 【解析】:酸鹼中和必產生鹽和水,選項中僅(B)為乙酸(醋酸)和氫氧化鈉,反應產生醋酸鈉和水,為酸鹼中和反應。 (
)5. 下列哪一種實驗可以檢驗出水溶液是酸性的? 【答案】:(E) 【解析】:(A)
溶液導電,必定為電解質,但可能是酸、鹼或是鹽; |
|
(
)6. 水在45 【答案】:(C) 【解析】:水的離子積=[H+][OH-]=10-14M2,但是[H+]=[OH-],因此溶液呈中性, (
)7. 生石灰的水溶液,以紅色石蕊試紙檢驗,應呈何種顏色? 【答案】:(A) 【解析】:生石灰CaO,溶於水成為氫氧化鈣Ca(OH)2,溶液呈鹼性,以石蕊試紙檢驗,溶液成藍色。 (
)8. 純水加熱至某一溫度時,pH值變為6.5,下列敘述何者正確? 【答案】:(D) 【解析】:純水加熱後解離度增加,H+濃度增加,pH值減小,水的離子機會變大,解離常數變大,但儲水依然為中性,且中性時的pH值不再是7,會比7小。 (
)9. 25 【答案】:(B) 【解析】:甲溶液pH值=6,乙溶液[H+]=10-4M pH值=4 (
)10. 某水溶液中 【答案】:(D) 【解析】:假設[OH-]離子濃度為X,[H+]離子濃度為100X,則: |
|
(
)11. 若 【答案】:(B) 【解析】:強酸與強鹼中和的莫耳反應熱為56KJ/mol水,硫酸與氫氧化鈉中和反應式為: (
)12. 下列有關酸鹼化學反應的敘述,何者正確? 【答案】:(A) 【解析】:(A)任何溫度下解離所得的水,含H+離子數與OH-離子數,離子數皆為1:1,因此純水必成中性。 (
)13. 於酸鹼反應中,有一種理論稱為阿瑞尼斯酸鹼學說,該學說定義:「酸乃為酸於水中可解離出氫離子( 【答案】:(B) 【解析】:依阿瑞尼士酸鹼溶液的定義,溶液中能解離出H+離子者,稱為酸。 (
)14. 氫離子濃度為 【答案】:(C) 【解析】:[H+]=1.x10-3M,則pH值=3 (
)15. 用多少體積的 【答案】:(C) 【解析】:鹽酸HCl為單質子酸,假設需鹽酸X毫升,則 |
|
(
)16. 我們喝的汽水中都含有CO2,若大華取一杯汽水,滴定其酸鹼度,求得氫離子濃度 [H+] 為4.0x10-5M,則此杯汽水的pH值約為多少?(log2 【答案】:(B) 【解析】:[H+]=4x10-5M,
1x10-5M<4x10-5M<1x10-4M 所以pH值範圍5>pH>4 (
)17. 有關酸的敘述,何者不正確? 【答案】:(B) 【解析】:石蕊試紙的變色範圍為4.3∼8.7,因此4.3∼7.0的酸性溶液不會呈紅色,無法判別是否為酸性。 (
)18. 柳橙中的檸檬酸與家用醋中的醋酸都是酸性水溶液,這是基於溶液中都含有下列哪種主要的粒子? 【答案】:(D) 【解析】:酸性水溶液的共同離子為H+離子,溶液中H+離子的濃度>OH-離子的濃度。 (
)19. 甲酸( 【答案】:(C) 【解析】:甲酸+氫氧化鈉→甲酸鈉+水 (
)20. 下列有關酸鹼物質的敘述,何項正確? 【答案】:(B) 【解析】:(A)HCl(g)為氯化氫氣體,水溶液才是氫氯酸。 (B)乾燥的HI(g)為分子化合物,氣態時呈中性,水溶液才是酸性。 (C)Sn(OH)4需+4價的Sn,才是氫氧化錫(Ⅳ)。 |
|
(
)21. 在25 【答案】:(A) 【解析】:(A)pH (
)22. 治療瘧疾的藥物,奎寧(Quinine)是一種有機鹼,可用標準濃度之HCl來中和。如果 【答案】:(A) 【解析】:酸中H+離子莫耳數=鹼中OH-離子莫耳數 (
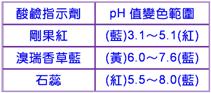
)23. 【答案】:(B) 【解析】:剛果紅呈紅色[PH>5.1,溴瑞香草藍測試呈黃色[PH<6.0,石蕊試紙測試呈紅色[PH<5.5,可知溶液的PH值介於5.1∼5.5間,[H+]濃度介於10-5M∼10-6M間。。 (
)24. 關於胃藥的成分,下列敘述何者不正確? 【答案】:(C) 【解析】:碳酸氫鈉為弱鹼,能中和胃酸,為速效型的胃藥。氫氧化鎂及氫氧化鋁為弱鹼,能持續性制酸及保護胃壁薄膜,屬於長效型胃藥。 (
)25. 可樂是夏天大眾化的消暑飲料之一,內含磷酸及碳酸的成分。某生經由滴定分析其酸鹼度,測得氫離子濃度為 【答案】:(B) 【解析】:[H+]=4x10-3M, 10-3<4x10-3<10-2, 3>PH>2 |
|
(
)26. 在 【答案】:(D) 【解析】:1公升的水質量1000克,水的莫耳數= (
)27. 下列何者是酸鹼中和反應? 【答案】:(A) 【解析】:酸鹼中和反應產生鹽+水,(A)CO2溶於水中呈碳酸H2CO3,為弱酸。 ( )28.
在25 【答案】:(A) 【解析】:25℃時,水溶液恆遵守[H+][OH-]=10-14M2,PH+POH=14。 |