|
(
)1. 用多少體積 【答案】:(C) 【解析】:酸鹼中和時,H+莫耳數=OH-莫耳數 (
)2. 下列有關酸鹼的敘述,何者錯誤? 【答案】:(D) 【解析】:NH3+H2O→NH4OH→NH4++OH- [ NH3為
分子化合物,溶於水形成氫氧化銨,在水中能部分解離OH-,水溶液呈弱鹼性。 (
)3. 熱水瓶用久,瓶內膽壁常附著一層水垢(主成分是CaCO3),下列何種物質可用來洗滌水垢? 【答案】:(A) 【解析】:水垢成分為碳酸鈣CaCO3,遇酸能產生CO2氣體,反應式為 (
)4. 下列有關酸、鹼的敘述,何者錯誤? 【答案】:(D) 【解析】:NH3+H2O→NH4OH→NH4++OH- [ NH3為
分子化合物,溶於水形成氫氧化銨,在水中能部分解離OH-,水溶液呈弱鹼性。 (
)5. 若紫甘藍菜呈紅色時,溶液的pH值約為2,則此時溶液中的 【答案】:(B) 【解析】:PH=2,則[H+]=10-2M, [OH-]=10-12M (
)6. 某一食醋樣品在25 【答案】:(D) 【解析】:PH=4,則[H+]=10-4M, [OH-]=10-10M (
)7. 下列哪一種實驗可以檢驗出水溶液是酸性的? 【答案】:(E) 【解析】:(A)水溶液導電,只是說明是電解質溶液,不一定是酸性溶液。 (
)8. 蜜蜂毒液的成分為甲酸;如果不幸被蜜蜂螫刺,應迅速使用下列何者,將毒液中和? 【答案】:(C) 【解析】:甲酸HCOOH呈酸性,為弱酸,只需以氨水(NH4OH氫氧化銨)中和,氫氧化鈉為強鹼,對皮膚有強烈的腐蝕性。 (
)9. 25℃取 【答案】:(D) 【解析】:氫氧化鈉NaOH分子量=40,0.4÷40=0.01莫耳 ( )10.
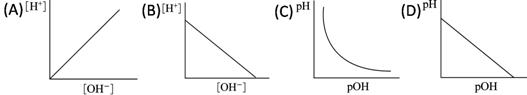
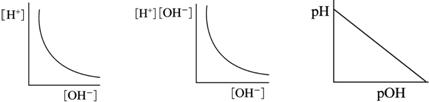
定溫下,下列有關水溶液中 【答案】:(B) 【解析】: |
|
(
)11. 實驗室中可用氨與鹽酸反應產生白色煙霧,來檢驗氨或鹽酸,其反應 【答案】:(A) 【解析】:氨氣NH3遇到酸性溶液,氨氣溶於水形成氫氧化銨NH4OH, (
)12. 下列有關酸的敘述,何者正確? 【答案】:(E) 【解析】:(A)鹼性溶液有滑膩感,酸性則無。 (B)酸使石蕊試紙呈紅色,使酚酞呈無色。 (
)13. 阿逃同學取得一杯汽水, 【答案】:(A) 【解析】:[OH-]=2x10-10M [ [H+]=5x10-5M [ 1x10-5<5x10-5<1x10+ (
)14. 25 【答案】:(C) 【解析】:[H+]>10-7M或 [OH-]<10-7M 溶液呈酸性, (
)15. 在 【答案】:(B) 【解析】:PH=3 [ [H+]=10-3M PH=11,[H+]=10-11M [OH-]=10-3M (
)16. 濃度均為 【答案】:(B) 【解析】:PH值愈小,則水溶液的酸性愈強,各物質中,HCl的酸性最強,其次為醋酸CH3COOH,NH4Cl為強酸弱鹼鹽,水溶液呈弱酸性。所以PH值:丙<乙<戊。 (
)17. 下列何者不是酸的一般通性? 【答案】:(D) 【解析】:(D)鹼性溶液有滑膩感,酸性則無。 (
)18. 柳橙中檸檬酸與家用醋酸都是酸性水溶液,這是基於溶液中都含有下列哪個主要的粒子? 【答案】:(D) 【解析】:酸的共同離子為氫離子,因此酸性溶液中H+離子濃度大於氫氧離子OH-濃度。 (
)19. 下列有關酸和鹼的敘述,何者正確? 【答案】:(D) 【解析】:(A)鹼性溶液有滑膩感,酸性則無。 (B)酸使石蕊試紙呈紅色,鹼性溶液則呈藍色。 (
)20. 能以 【答案】:(A) 【解析】:強酸與強鹼的中和反應之淨離子反應式皆可用H+(aq)+OH-(aq)→H2O(aq)來表示。 |
|
(
)21. 為避免土壤過度酸化,通常在土壤表面灑些何種物質以降低土壤酸性? 【答案】:(C) 【解析】:氧化鈣溶於水成為氫氧化鈣溶液,呈鹼性。 (
)22. 於25℃時,某溶液之 【答案】:(B) 【解析】:25℃時,[H+]=10-5M,則[OH-]=10-9M,溶液成酸性。 (
)23. 下列有關強酸的敘述,何者錯誤? 【答案】:(D) 【解析】:(D)大部分強酸和強鹼會發生中和反應產生鹽和水,為放熱反應,能放出大量的熱,使溶液的溫度升高。 (
)24. 下列何項的淨離子反應方程式可用H+(aq)+ OH-(aq) → H2O(l)
來表示? 【答案】:(B) 【解析】:H+(aq)+ OH-(aq) → H2O(L)
為強酸和強鹼的反應。 (
)25. 下列為強酸或強鹼的化學式,哪一個是錯誤的? 【答案】:(C) 【解析】:鹼金族離子為+1價離子,溶於水形成氫氧化物,能解離出OH-離子。 (
)26. 下列何者可作為阿瑞尼斯鹼? 【答案】:(B) 【解析】:物質溶於水中,能解離出OH-
者,為阿瑞尼斯鹼。 (
)27. 有關酸鹼的敘述,下列何者錯誤? 【答案】:(D) 【解析】:NH3+H2O→NH4OH→NH4++OH- [ NH3為
分子化合物,溶於水形成氫氧化銨,在水中能部分解離OH-,水溶液呈弱鹼性。 (
)28. 下列何者敘述,不符合酸的性質? 【答案】:(B) 【解析】:(B)水溶液有滑膩感的是鹼性溶液。 (
)29. 下列化合物的命名,何者錯誤? 【答案】:(A) 【解析】:(A)HCN(g)為氰化氫氣體,溶於水才能成為氫氰酸HCN(aq)。 (
)30. 下列有關酸、鹼的中文名稱何者正確? 【答案】:(C) 【解析】:(A)HClO2亞氯酸,HClO次氯酸 (B)HMnO4過錳酸 (C)Sn(OH)4氫氧化錫 (D)HCN氫氰酸。 |