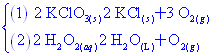|
|
|||||||||||||||||||||||||||||||||||||||
|
(一)
化學反應的型式: A、
結合反應(化合反應): (1) 由兩種(或兩種以上)物質相互反應,生成另一種與原來不同物質的反應型式。 (2) (3) 實例: B、
分解反應: (1) 由一種物質分解生成多種元素或化合物的反應型式。 (2) 通式:AB→A+B (3) 實例: C、
置換反應: (1) 又稱為取代反應,化合物中的某一組成元素被其他元素單質所取代的反應。 (2) 通式:A+BC → B+AC (3) 實例: D、
複分解反應: (1) 兩種化合物互相交換成分,生成另外兩種化合物的反應,多數發生在水溶液中。 (2) 通式: AB+CD→CB+AD (3) 實例:【註】:金屬取代金屬,非金屬取代非金屬,或正價元素取代正價元素。 E、
燃燒反應: (1) 物質產生劇烈的氧化作用,同時有光和熱產生。 (2) 實例:【註】:C、H或C、H、O化合物完全燃燒,產物為CO2與H2O。 F、 聚合反應: (1)
許多單體小分子反應,產生分子量很大的高分子化合物。 (2)
實例: |
|||||||||||||||||||||||||||||||||||||||
|
(二) 化學反應伴隨的現象:
A、 顏色的變化: (1)
由於反應物或生成物本身顏色的有無,以致反應過程中可能觀察到顏色的改變。 B、 氣體的生成: (1)
固、液相反應,若產物之一為氣體,則很容易觀察到氣體的產生。 C、 沉澱的產生: (1) 液相的反應,若有生成難溶物,就會有沉澱被觀察到。 D、 能量的變化: (1)
化學反應一定會有吸熱或放熱現象發生,若在液相中進行,則液相溫度也會有上升或下降的現象。 (2)
放熱反應時,將熱放至溶液中,則溶液的溫度會上升; |
|||||||||||||||||||||||||||||||||||||||
|
(三)
常見的化學沉澱口訣: A、
全部為可溶之離子: NO3-、CH3COO-、IA+、
NH4+ B、
Cl-、Br-、I-與下列離子均可產生沉澱: *常用:氯化銀[白色 溴化銀[淡黃色 碘化銀[黃色 C、
硫酸根SO42-與下列離子均可產生沉澱:Sr2+、Ba2+、 Pb2+、Ca2+、Ra2+ ² 硫酸根
+ 鈣,鍶,鋇,鉛
離子 [ 沉澱
(都白色) D、
草酸根(C2O42-)與下列離子均可產生沉澱:Ag+、Pb2+、Ca2+、Sr2+、Ba2+ E、
鉻酸根CrO42-與下列離子可產生沉澱: Sr2+、Ba2+、Hg22+、Cu2+、Pb2+、Ag+ ² 鉻酸根
+ 銀,鉛,鍶,鋇 離子
[ 沉澱 (大多黃色,
除鉻酸銀 [ 紅色) F、
氟離子與下列離子可產生沉澱: Mg2+、Ca2+、Sr2+、Ba2+、Pb2+ G、
兩性氫氧化物:Sn(OH)2、Be(OH)2、Cr(OH)3、Al(OH)3、Pb(OH)2、Zn(OH)2、Ga(OH)3 難溶於水,但可溶於強酸及強鹼 { 兩性氫氧化物: 鉻 鉍 錫 鈹 鋁 鉛 鋅 鎵 兩性金屬:Cr3+、Bi3+、Sn2+、Be2+、Al3+、Pb2+、Zn2+、Ga3+ 兩性金屬的氫氧化物難溶於水,但可溶於強酸或強鹼中 H、
過渡金屬離子:Cd2+、Cr2+、Ag+、Co2+、Ni2+、Cu2+、Zn2+ |
|||||||||||||||||||||||||||||||||||||||
|
(四)
離子方程式的表示: A、
化學反應方程式: 氯化鈣
+ 碳酸鈉 → 氯化鈉 +
碳酸鈣↓ B、
化學反應方程式: 氫氧化鈉
+ 硫酸 → 硫酸鋇 +
水 C、
化學反應方程式: 碳酸鈣
+ 鹽酸 → 氯化鈣 +
水+二氧化碳 D、
化學反應方程式: 鋅
+ 硫酸銅 → 銅 +
硫酸鋅 E、
化學反應方程式: 鋅
+ 鹽酸 → 氯化鋅 +
氫 |
|||||||||||||||||||||||||||||||||||||||
|
(五) 常見離子化合物對水的溶解度
|
|||||||||||||||||||||||||||||||||||||||
|
(六)
電解質的分類: A、 定義:化合物在熔融狀態,或【水溶液】狀態能導電,且電流通過時發生【化學】反應,即稱為電解質。 B、 種類:
(1) 酸:調味品中的食醋含【乙酸(醋酸)】(化學式【CH
洗廁所的鹽酸含【氯化氫】(化學式【HCl】)。
洗眼藥水內含【硼酸】(化學式【H3BO3】)。
(2) 鹼:熟石灰,學名【氫氧化鈣】(化學式【Ca(OH)2】)。
燒鹼,又稱為【苛性鈉】,學名【氫氧化鈉】(化學式【NaOH】)。
氨水,學名【氫氧化銨】(化學式為【NH4OH】)。
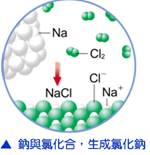
(3) 鹽:飲食中的食鹽,學名【氯化鈉】(化學式【NaCl】)。
製香腸所加入的硝,學名【硝酸鉀】(化學式【KNO3】)。
檢驗水的硫酸銅,俗稱【藍礬】(又稱【膽礬】;化學式【CuSO4】)。 C、 導電狀態的判斷:
(1) 酸為分子化合物,在液態時不能導電。 (2) 鹼和鹽為離子化合物,在液態(熔融狀態)及水溶液狀態可以導電。 D、 解離說: (1) 電解質在水中解離成陰離子和陽離子兩種粒子;其中兩者個數不一定相等,但是兩者的電量必相等,因此溶液必定保持【電中性】。 (2) 電解質導電是由於【陰離子】和【陽離子】的移動。 |
|||||||||||||||||||||||||||||||||||||||
|
( )1. 下列敘述何者正確? 【解答】:(D) 【解析】:銅能導電,銅為導體,不是電解質; 食鹽晶體不能導電,但是水溶液能導電,因此食鹽水是電解質; 汞為液態金屬,能導電,為導體,但不是電解質; ( )2. (甲)電解質在固態時不會導電,但是溶於水後會導電; (乙)電解反應是將電能轉變成化學能; (丙)酸、鹼、鹽類的化合物大多為電解質; (丁)電解質導電是利用自由電子的移動,以上敘述正確者為 【解答】:(A) 【解析】:電解質溶液在水中能解離,成為陽離子與陰離子,由於陰、陽離子的存在,因此溶液能具有導電性。 ( )3. 下列有關電解質的敘述,何者正確? 【解答】:(B)(C) 【解析】:氣態的二氧化硫不能導電,但是溶於水能成為亞硫酸,會解離出離子,因此溶液能導電,二氧化硫為電解質。 ( )4. 下列有關硫酸鉀水溶液的敘述,何者正確? 【解答】:(C)(D)(E) 【解析】:K2SO4解離成2K+和SO42-,離子數目比=2:1。 |
|||||||||||||||||||||||||||||||||||||||
|
1.
試將下列化學反應,歸類於四大反應類型:(甲)化合、(乙)分解、(丙)取代、(丁)複分解。
|
|||||||||||||||||||||||||||||||||||||||