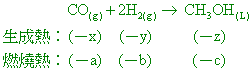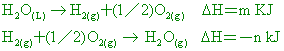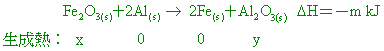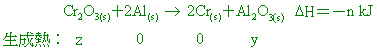|
( )1.
關於氫氣的燃燒反應:2H2(g)+O2(g)→ 2H2O(L)的敘述,下列何者正確? 【答案】:(C) 【解析】:(A)燃燒為放熱反應,ΔH必為負值。 ( )2.
試利用下列熱化學方程式:C6H6+ 【答案】:(D) 【解析】: ( )3.
(甲)H2O(s)+Q1 → H2O(L) (乙)H2O(L)+Q2 → H2O(g) (丙)H2O(g)→
H2(g)+ 【答案】:(B) 【解析】:(甲)H2O(s)
→ H2O(L) DH=Q1 為熔化熱(物理變化) ( )4.
已知CO(g)、H2(g)、CH3OH(L)之生成熱分別為 -x、-y、-z千焦/莫耳,燃燒熱分別為 -a、-b、-c千焦/莫耳;又已知CO(g)+2H2(g)→ CH3OH(L),則: 【答案】:(D) 【解析】: ( )5.
關於熱化學方程式C(s)+O2(g)→ CO2(g),DH=-394(kJ/moL),下列敘述何者正確? 【答案】:(B) 【解析】:C(s)+O2(g)→ CO2(g),DH=-394(kcAl/moL)為燃燒反應,為放熱反應 DH為負值。 ( )6.
下列何種物質之莫耳生成熱為零? 【答案】:(C) 【解析】:元素的生成熱為零,Ne(g)為惰性氣體,為單原子元素氣體,生成熱為零。 ( )7.
標準狀況下,已知CO2標準莫耳生成熱為 – 393.6千焦,且3C(s)+2Fe2O3(s)→4Fe(s)+3CO2(g) DH=463.6kJ,試問Fe2O3之標準莫耳生成熱應為多少kJ? 【答案】:(C) 【解析】: ( )8.
已知25℃、1atm時: 【答案】:(B) 【解析】:2H2(g)+O2(g)→2H2O(L)+572KJ [ 2莫耳的水生成熱=572KJ ( )9.
在1 atm、 【答案】:(D) 【解析】:H2的燃燒熱=H2O的生成熱=-285.5
KJ ( )10.
已知燃燒熱(kcAl/moL):N2H4(-150),H2(-68.3),C(-94),CH4(-213),則下列何項完全燃燒時,放熱最多? 【答案】:(C) 【解析】:(A) |
|
( )11.
已知1 atm、 【答案】:(B) 【解析】:2H2(g)+O2(g)→2H2O(L)+572KJ [ 2H2O(L)→2H2(g)+O2(g) DH=+572KJ ( )12.
下列關於反應熱之敘述,何者正確? 【答案】:(A) 【解析】:(A)正確,反應熱只和反應物及生成物的狀態有關,而與反應的途徑無關。 ( )13.
已知H2(g)+ 【答案】:(D) 【解析】:水的克蒸發熱是指1克水蒸發需吸熱aKJ,則1莫耳H2O蒸發需吸熱 ( )14.
試利用下列五個方程式求第一式中之Q值為何? 【答案】:(D) 【解析】: ( )15.
在 【答案】:(C) 【解析】:水的生成熱=-572/2=-286KJ 但H2O(L)→
H2O(g) ΔH=+44(kJ) , ( )16.
已知C2H4(g)之莫耳生成熱為+12.5千卡;H2O(L)、CO2(g)之莫耳生成熱分別為 -68.3千卡、-94.0千卡;C2H5OH(L)之莫耳燃燒熱為 -326.5千卡,試求:C2H4(g)+H2O(L)→ C2H5OH(L)之DH=? 【答案】:(D) 【解析】:先求出酒精的生成熱: ( )17.
1莫耳甲烷之燃燒熱為-890KJ,則 【答案】:(B) 【解析】:1莫耳甲烷=16克,4克的甲烷CH4=4/16=0.25莫耳 ( )18.
已知A+B → C+D,DH1=20.5(kJ);C+D → E+F,DH2=-41(kJ),則A+B → E+F,DH=? 【答案】:(B) 【解析】:A+B → C+D,DH1=20.5(kJ)……(1) ; C+D → E+F,DH2=-41(kJ)……(2) ( )19.
已知CO(g)及HCOOH(L)的莫耳燃燒熱依次分別為DH=-67.6千卡與DH=-62.8千卡,H2O(L)的莫耳生成熱DH=-68.3千卡,則CO(g)+H2O(L)→
HCOOH(L)的反應熱DH值為何? 【答案】:(A) 【解析】: ( )20.
已知莫耳燃燒熱:C6H6(L)(-781.0千卡);H2(-68.3千卡);C6H12(L)(-936.9千卡),試求C6H6(L)+3H2(g)→ C6H12(L)之DH=? 【答案】:(B) 【解析】: |
|
( )21.
Fe2O3(s)+2Al(s)→ 2Fe(s)+Al2O3(s)+m kJ Cr2O3(s)+2Al(s)→ 2Cr(s)+Al2O3(s)+n kJ 【答案】:(B) 【解析】: ( )22.
已知CH4(g)的莫耳燃燒熱為-893.8 kJ,且H2O(L)的莫耳生成熱為-286.9 kJ,試求 【答案】:(B) 【解析】: ( )23.
在1 atm、300 K時,下列 【答案】:(C) 【解析】:分子量愈大,莫耳燃燒熱愈大,放熱愈多,在STP下,1莫耳氣體體積=22.4升, ( )24.
設 【答案】:(C) 【解析】:Fe2O3的生成熱=-400/2=-200KcAl |