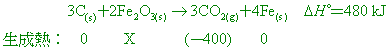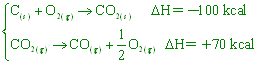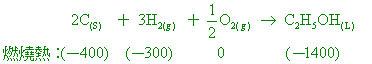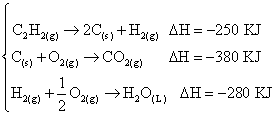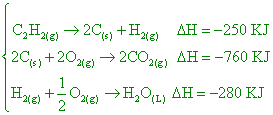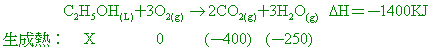|
1.
已知:CO2之標準莫耳生成熱為 -400 kJ/mol,且 【答案】: ΔH=-840KJ 【解析】: 2.
燃燒 【答案】:(1)
-400Kcal/mol 【解析】:H=mst=(2kg)x1x(60-20)=80 Kcal 3.
已知乙醇的標準莫耳燃燒熱為-1400 kJ,碳的標準莫耳燃燒熱為-400 kJ,氫的標準莫耳燃燒熱為-250 kJ,求下列各題: 【答案】:(2) C2H5OH(L)
+ 3O2(g) →
2CO2(g)+3H2O(g) ΔH=-1400KJ 【解析】:(1-1) 赫斯定律又稱為反應熱加成定律,說明一個化學反應的熱量變化,只和反應物 4.
已知CH4,C2H6的莫耳燃燒熱分別放熱860 千焦、1600千焦,試比較甲烷及乙烷每克燃燒放出熱量的大小。 【答案】:CH4的克燃燒熱大於C2H6的克燃燒熱 【解析】:CH4的分子量=12+4=16 C2H6的分子量=24+6=30 5.
【答案】:(1)
H2(g)+(1/2)O2(g)→H2O(L) △H=-300KJ 【解析】:(1) H2(g)+(1/2)O2(g)→H2O(L) △H=-300KJ |
|
6.
若燃燒3克的碳生成二氧化碳,可以使3公斤的水溫度由25℃上升至35℃,請寫出熱化學方程式。(原子量:C=12) 【答案】:C(s)+O2(g) → CO2(g) ΔH=-120Kcal 【解析】:H=mst=3kg x 1 x (35-25)=30Kcal C原子量=12 7.
若已知 【答案】: C(s)+(1/2)O2(g) → CO(g) ΔH=-30Kcal 【解析】: 8.
已知C2H5OH(l)、C(s) 及H2(g) 的莫耳燃燒熱分別為 -1400千焦、-400千焦及 -300千焦,試求C2H5OH(l)
的莫耳生成熱。 【答案】: 【解析】:(1)以燃燒熱求得生成熱: 9.
【解析】: 10. 已知CO(g) 及HCOOH(l) 的燃燒熱依次分別為DH=-85(kcal/mol)與DH=-60(kcal/mol),H2O(l) 的生成熱DH=-70 (kcal/mol),則CO(g) + H2O(l)
→ HCOOH(l) 的反應熱DH值為何? 【答案】:-25Kcal 【解析】: |
|
11. C(s)
+ 【答案】:CH4+2O2 → CO2+2H2O DH=-190Kcal 【解析】:(1)以燃燒熱求得生成熱: 12. .若A → B DH=+50千焦,B → C DH=-25千焦,則A → C DH=? 【答案】:25KJ 【解析】: 13. .已知C(s)+O2(g) → CO2(g) DH=-400千焦,2H2(g)+O2(g) → 2H2O(l) DH=-500千焦,C2H5OH(l)的莫耳燃燒熱為-1400千焦,則C2H5OH(l)的莫耳生成熱=? 【答案】:-150KJ 【解析】:(1) 以生成熱求得燃燒熱: 14. 已知C2H6(g)、CO2(g)、H2O(l)之莫耳生成熱依次為-80 kJ、-400 kJ、-300 kJ,求乙烷的莫耳燃燒熱為何?C2H6(g)
+ O2(g)
→ CO2(g) + H2O(l)(係數未平衡)。 【答案】:-1620
KJ 【解析】:(1) 以生成熱求得燃燒熱: |