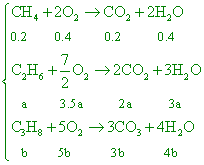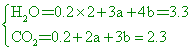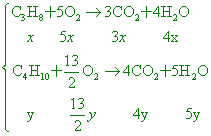|
( )1.
反應3A 【答案】:(B) 【解析】:反應前後遵守質量守恆:3A+2B
→
2C [ 3莫耳A和2莫耳B反應,產生2莫耳C ( )2.
將鐵片放入硝酸銀溶液中,等鐵片表面附有一層金屬銀後取出(反應式為 【答案】:(D) 【解析】:1Fe+2Ag+
→
2Ag+1Fe2+ [ 鐵片溶解產生銀, ( )3.
有關24.5克的氯酸鉀固體強熱後的結果 【答案】:(D) 【解析】:2KClO3
→ 2KCl+3O2 ( )4.
每人每天平均約需消耗540公升的氧氣以維持其生存與活動之所需,而若欲於冬天提供一個人淋浴所需的熱水,則天然氣的供氣速率約需達每分鐘30公升。當供應的天然氣為純甲烷,且能完全燃燒而消耗了540公升的氧氣(每人一天生存與活動所需的氧)時,約可維持一個人多少分鐘的淋浴時間? 【答案】:(B) 【解析】:CH4+2O2 → CO2+2H2O 氣體反應體積比=莫耳數比=方程式的係數比 ( )5.
水與煤在高溫下反應可得到水煤氣,其反應式為 【答案】:(C) 【解析】:C+H2O → CO+H2 12克C=1莫耳C |
|
( )6.
有一胃病患者,檢查顯示其胃液中所含氫氯酸的濃度為0.060莫耳/升,用含氫氧化鋁 【答案】:(D) 【解析】:胃液中含氯化氫0.3x0.06=0.018莫耳 中和時H+莫耳數=OH-莫耳數 ( )7.
汽車的安全氣囊在汽車發生車禍時,會利用疊氮化鈉的高溫分解反應,迅速產生氮氣( 【答案】:(C) 【解析】:2NaN3
→
2Na+3N2 [ 73.5升的N2= ( )8.
某灰石(主成份為 【答案】:(A) 【解析】:CaCO3
→
CaO+CO2 重量減輕是因為產生的CO2逃逸, ( )9.
設將過量的食鹽水溶液加入硝酸銀溶液中,可發生下列淨離子反應: 【答案】:(B) 【解析】:0.5
M的NaCl(aq) 100mL=0.5x0.1=0.05莫耳 [ Cl-莫耳數=0.05莫耳 ( )10.
今有C2H4(g)及C2H5OH(g)體積比為3:1之混合氣體V升,當其完全燃燒時,所需氧氣的體積在同溫同壓下應為何? 【答案】:(D) 【解析】:C2H4+3O2 → 2CO2+2H2O [ |
|
( )11.
m克的鎂片在氧氣中完全燃燒生成n克的氧化鎂,則鎂的原子量為 【答案】:(B) 【解析】:2Mg+O2 → 2MgO Mg:MgO=1:1 [ ( )12.
取 【答案】:(D) 【解析】: ( )13.
已知火箭中的燃料聯胺 【答案】:(A) 【解析】:N2H4分子量=32 N2O4分子量=92 2N2H4+N2O4 →
3N2+4H2O ( )14.
已知丙烷( 【答案】:(D) 【解析】:C3H8分子量=44 C3H8+5O2 → 3CO2+4H2O
[ 2.24升丙烷=2.24÷22.4=0.1莫耳 ( )15.
將鐵片放入硫酸銅溶液中,等鐵片表面附有一層金屬銅後取出,洗淨乾燥,然後秤量時,得知其重量增加 【答案】:(B) 【解析】:Fe+CuSO4 → FeSO4 +Cu [ 消耗1個Fe,產生1個Cu |
|
( )16.
世界各國為了有效控制並減緩溫室效應的持續惡化,減少二氧化碳的排放量,擬開徵碳排放稅。今有一液化瓦斯鋼桶,內裝有13.2kg的液化丙烷C3H8,已知丙烷完全燃燒的反應式:C3H8+5O2 → 3CO2+4H2O,
若在27℃、1atm下,排放每1000L的 【答案】:(C) 【解析】:排放1000L的CO2=1000÷24.6=40.65莫耳
[ 產生40.65莫耳的CO2課稅1元 ( )17.
甲烷0.2莫耳,乙烷a莫耳及丙烷b莫耳的混合氣體完全燃燒時,得3.3莫耳水蒸氣及2.3莫耳二氧化碳。下列各項敘述中何者有錯誤? 【答案】:(B) 【解析】: ( )18.
綠色化學的概念強調化學製程中原子使用效率,若製程中使用很多原子,最後這些原子卻成為廢棄物,就不符合綠色化學的原則。原子使用效率定義為:化學反應式中,想要獲得的產物的莫耳質量(分子量)除以所有生成物的莫耳質量(分子量)。甲基丙烯酸甲酯是一個製造壓克力高分子的單體,以往是由丙酮製造,完整製程可用下列平衡化學反應式表示: 【答案】:(C) 【解析】: ( )19.
已知 【答案】:(A) 【解析】:
2SO2+O2+2H2O
→ 2H2SO4
[ SO2:O2:H2O=2:1:2 ( )20.
某試樣含碳酸鈣與硫酸鈣之混合物 【答案】:(A) 【解析】:固體質量減少4.70-3.16=1.54克CO2質量=0.035莫耳 |
|
( )21.
使丙烷和丁烷的混合氣體完全燃燒時得二氧化碳 【答案】:(C) 【解析】:
假設C3H8有x莫耳,C4H10有y莫耳, |