|
( )1.
下列各數為週期表元素的原子序,則其中哪一組為鹼土金屬元素? 【答案】:(B) 【解析】:惰性氣體(8A族)的原子序為2、10、18、36、54、86。 ( )2.
下列為各元素的原子序,何者的電子排列中,最外層的電子數與其他三者不同? 【答案】:(D) 【解析】:惰性氣體(8A族)的原子序為2、10、18、36、54、86。 ( )3.
下到各數字代表週期表元素之原子序,何組的化學性質最相似? 【答案】:(D) 【解析】:(A)12-10=2、20-18=2,為2A族元素。28為過渡元素。 ( )4.
【答案】:(D) 【解析】:因為第一週期只有2個元素,因此圖中1∼36的元素只可能是第2∼4週期。 ( )5.
下列各元素中,何者的化學性質與其他三者有顯著的差異? 【答案】:(C) 【解析】:(A)Cu:銅 (B)Ni:鎳 (D)Mn:錳 都是金屬;只有
(C)As:砷 為非金屬,性質差異最大。 ( )6.
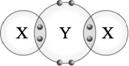
【答案】:(C) 【解析】:圖為共價分子,化學式為X2Y,其中X有1個價電子,為1A族元素,Y有6個價電子,為6A族元素。 ( )7.
依照門得列夫的週期表,Ni應排在Co的前面,但今是一個錯誤,今日Co、Ni在週期表的位置已更正為Co排在Ni的前面,試問這種排列方式是依據下列哪一項理由? 【答案】:(B) 【解析】:門德列夫誤將Ni排在前面是錯誤的,因為依原子量排列時,Ni的原子量比Co的原子量小,但是按照原子序排列時,Co的原子序較小,應排在在Ni的前面。 ( )8.
相同週期的元素,當原子序增加時,則下列何項正確? 【答案】:(B) 【解析】:同一週期的原子序愈大,價電子愈多,非金屬性質愈強,金屬性質愈弱,因此隨著價電子數增加,元素的導電性愈差。由於非金屬性質逐漸增強,因此氧化物的酸性愈強。 ( )9.
下列關於鹼金族元素的敘述,何者錯誤? 【答案】:(B) 【解析】:鹼金族元素隨著原子序增加,原子半徑增大,價電子距離中心原子核愈遠,因此價電子愈容易脫離,金屬的活性增大,游離能鹼小,金屬氧化物的鹼性也愈強,容易形成+1價的陽離子。 ( )10.
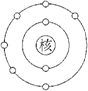
【答案】:(C) 【解析】:圖中,電子的組態為(2,6)因此為6A族元素氧(O),為非金屬元素;當電子填滿8個時為最安定狀態,因此再填入2個電子,成為O2-時為安定的電子組態。 |
|
( )11.
某金屬氟化物化學式為MF3,電子總數為53,每個M離子有23個電子,已知氟原子核中有10個中子,MF3分子量為113(設M及F都沒有同位素存在),則下列敘述何者錯誤? 【答案】:(C) 【解析】:F為氟,原子序9,原子核外有9個電子,因此 ( )12.
下列有關元素週期表的敘述,何項正確? 【答案】:(D) 【解析】:同一族的化學性質相似,同一週期由於價電子數目不同,化學性質不相似,價電子愈多,非金屬性質愈強,金屬性質愈弱,但是價電子數有週期性的變化,1、3、11、19、37、55、87都為1個價電子。 第5週期的元素數目=54-36=18個元素。 ( )13.
關於第三列元素,何者錯誤? 【答案】:(A) 【解析】:非金屬元素最強的是氟,惰性氣體最安定,活性為最小。 ( )14.
有關元素週期表的敘述,下列何項錯誤? 【答案】:(B) 【解析】:惰性氣體(8A族)的原子序為2、10、18、36、54、86。因此每一週期的元素個數分別為2、8、8、18、18、32。 原子序54為惰性氣體氙(Xe)。 ( )15.
有關ⅥA族金屬性的敘述,何者正確? 【答案】:(A) 【解析】:同一族元素隨著原子序增加,金屬性質增強。 ( )16.
Ar、K+、Ca2+、Cl-、S2-五種原子或離子皆有相同數目的電子,其中體積最大與最小的為: 【答案】:(B) 【解析】:18Ar、19K+、20Ca2+、17Cl-、16S2-,皆為18個電子,電子數目都相同,但是Ca的原子核質子最多,靜電力最大,因此原子半徑最小,而16S2-的原子核內質子數目最少,因此靜電力最小,原子半徑最大。半徑大小:16S2->17Cl->18Ar>19K+>20Ca2+。 ( )17.
某週期中的三個元素以X、Y、Z表示,若其氧化物分別為酸性、鹼性、中性,則關於此三者原子序的大小順序,何者正確? 【答案】:(B) 【解析】:X的氧化物呈酸性,表示X為非金屬元素,價電子最多,在週期表的右邊; ( )18.
下列哪一項不是門德列夫對化學的頁獻? 【答案】:(A) 【解析】:門德列夫依照原子量的順序排出週期表,週期表依照原子序排列的概念是莫斯利提出。 ( )19.
下列有關元素與週期表的敘述,何者正確? 【答案】:(C) 【解析】:(A)溴(Br)為第四週期元素,溴離子Br-與惰性氣體氪(Kr)的電子組態相同。 ( )20.
下列有關元素電子排列及價電子的敘述,何者錯誤? 【答案】:(C) 【解析】:第二層電子為n=2,因此電子數可容納2x22=8個電子。 |
|
( )21.
下列敘述何者錯誤? 【答案】:(C) 【解析】:(C)錯誤,原子其最外層電子數等於該元素所在的族數(A族),但是不包含氦(He),氦為8A族只有2個價電子。同一週期的不同元素,價電子數目不同,僅電子存在的價殼層相同。同位素由於不同中子,因此化學性質相同,但是物理性質不同。 ( )22.
下列關於週期表的敘述,何者正確? 【答案】:(A) 【解析】:週期表中在金屬與非金屬間的交界,有一梯形排列的類金屬元素。 ( )23.
第二週期的元素,當原子序增加時,下列敘述何項正確? 【答案】:(C) 【解析】:同一族的化學性質相似,但是同一週期由於價電子數目不同,化學性質不相似,原子序增加時,價電子愈多,非金屬性質愈強,金屬性質愈弱, ( )24.
有關元素週期表之下列敘述,何項正確? 【答案】:(D) 【解析】:193年時英國的莫斯利進行陰極射線實驗時,發現原子序愈大,陰極射線產生的X光頻率愈大,因此認為原子序與元素的性質有關,原子核內的正電荷數決定元素的種類及性質,因此將週期表依原子序排列,成為現今的週期表。 ( )25.
下列有關元素週期性質及週期表的敘述,何者正確? 【答案】:(B) 【解析】:(A)現在的週期表是依各元素的"原子序"從小到大的順序排列。 下列有關鹼金屬之敘述,何者不正確? ( )27.
【答案】:(C) 【解析】:同一族元素,原子序增加,原子半徑也增加;同一週期,原子序大,原子半徑會漸小。 ( )28.
下列有關元素與週期表的敘述,何者正確? 【答案】:(C) 【解析】:(A)溴(Br)為第四週期元素,溴離子Br-與惰性氣體氪(Kr)的電子組態相同。 |