|
( )1. α粒子實際上為下列何者?
(A) e - (B) H + (C) He 2+ (D) Li 3+ (E) D +。
【答案】:(C)
【解析】:α粒子實際上為氦原子核,原子序2,原子量4,原子核內有2個質子,2個中子,帶正電。
( )2. (甲)、(乙)、(丙)、(丁)四種實驗,哪幾種實驗的結果組合後可以決定電子的質量?
(甲):拉塞福的 a 粒子散射實驗; (乙)湯姆森的陰極射線實驗;
(丙)侖琴的X射線實驗; (丁)密立坎的油滴實驗。
(A)甲、乙、丙、丁 (B)甲、乙、丙 (C)乙、丁 (D)丙、丁 (E)甲、丙
【答案】:(C)
【解析】:1897年,湯姆森研究陰極射線,發現電子的核質比,求得e/m=1.759x1011庫倫/公斤,
1909年,密立坎的油滴實驗,測得電子的帶電量為1.602x10-19庫侖,因此將電子電量代入核質比(e/m),間接求得電子的質量為9.1x10-31公斤。
( )3. 1911年拉塞福做「α粒子散射」實驗,將α粒子束射向一金屬薄膜,觀察透過膜後的粒子偏折至各方向的分布情形。他發現絕大部分的粒子,穿過薄膜後,仍按原來方向進行,但少數的粒子,則有大的散射角,極少數竟有180°的散射。已知α粒子是He的原子核,由此實驗結果,無法說明原子核的何種特性?
(A)原子核帶正電 (B)原子核具有原子絕大部分的質量 (C)原子核的直徑小 (D)原子核是質子和中子組成
【答案】:(D)
【解析】:拉塞福做「α粒子散射」實驗,僅能發現在原子內部有一個體積很小,質量很大的原子核,且原子核帶正電,能使少數的α粒子受到靜電力產生方向偏折,但是無法證明在原子核的內部包含質子和中子。
( )4. 1911年拉塞福提出的原子模型為:
(A)有核的原子模型 (B)原子的質量均勻分布在原子中 (C)電子集中於原子核 (D)原子核不帶電
【答案】:(A)
【解析】:1911年拉塞福提出的原子模型為”行星模型”,原子內部有一個體積極小,質量很大的原子核,電子在原子核的外圍,繞著原子核旋轉,如同太陽系的行星繞著太陽公轉一般。
電子環繞原子核的最外圍軌道,即為原子的大小。
( )5. 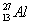 的中子數為若干? 的中子數為若干?
(A) 27 (B) 19 (C) 14 (D) 13 (E) 11
【答案】:(C)
【解析】:鋁的原子續為13,質量數為27,因此質子數+中子數=27,而質子數則為13,因此中子數=質量數-質子數=27-13=14。
( )6. 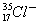 離子中的電子數、質子數、中子數分別為何? 離子中的電子數、質子數、中子數分別為何?
(A)(18,18,17) (B)(17,18,18) (C)(18,17,18) (D)(18,17,17)
【答案】:(C)
【解析】:左下角為原子序,即為質子數=17,左上角為值兩樹=質子數+中子數,因此中子數=質量數-質子數=35-17=18個中子。
右上角為帶電量,有一個負電,表示電子比質子多一個,所以電子數=質子數+1=17+1=18個電子。
共有18個電子,17個質子,18個中子。
( )7.  和 和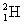 是氫的兩種同位素,下列各敘述何者正確? 是氫的兩種同位素,下列各敘述何者正確?
(1)兩者皆有相同質量數;(2)兩者皆有相同電子數;(3)兩者皆有相同的物性;(4)兩者在空氣中燃燒時皆有爆嗚聲。
(A)僅(1) (B)僅(1),(2) (C)僅(2),(3) (D)僅(2),(4)
【答案】:(D)
【解析】: 和 和 是氫的兩種同位素,有相同的原子序(相同的質子數),因此化學性質相同,但是中子數不同,因此質量不同, 是氫的兩種同位素,有相同的原子序(相同的質子數),因此化學性質相同,但是中子數不同,因此質量不同, 僅有1科質子,沒有中子, 僅有1科質子,沒有中子, 個中子。 個中子。
同位素的質子數相同,因此化學性質相同;但是中子數不同,因此物理性質不同。
(1)兩者有不同質量數; (2)原子不帶電,因此電子數=質子數,兩者皆有相同電子數;
(3)兩者皆有相同的化學性質,但是不同的物理性質;(4)兩者化學反應的性質相同,因此在空氣中燃燒時,氫氣燃燒皆有爆嗚聲。
( )8. X2+與Y- 都具有18個電子及20個中子,下列有關X、Y兩元素的敘述,何者正確?
(A) X之質量數為38 (B) 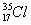 為Y之同位素 (C) X2+ 和Y- 為同素異形體 (D) X和Y具有相同的質子數目 為Y之同位素 (C) X2+ 和Y- 為同素異形體 (D) X和Y具有相同的質子數目
【答案】:(B)
【解析】:X2+有18個電子,所以質子數=18+2=20個質子,20個中子,質量數=20+20=40
Y-有18個電子,所以質子數=18-1=17個質子,20個中子,質量數=17+20=37
( )9. 一個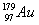 原子含: 原子含:
(A)197個質子 (B)79個中子 (C)79個電子 (D)118個質子
【答案】:(C)
【解析】: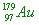 原子序為97,有97個質子,質量數=質子數+中子數=179,97+中子=179,所以中子數=179-97=82個中子,中性原子有97個電子。 原子序為97,有97個質子,質量數=質子數+中子數=179,97+中子=179,所以中子數=179-97=82個中子,中性原子有97個電子。
( )10. 下列各粒子,何者質量最小?
(A)質子 (B)中子 (C) α粒子 (D) β粒子
【答案】:(D)
【解析】:(D) β粒子為帶負電的高速電子流,質量最小,為質子質量的1/1836倍。
α粒子有2個質子、2個中子,質量數為4amu;
中子比質子略重,可視為相等,中子=質子=1amu;
四者質量大小依次為α粒子>中子>質子>β粒子。
( )11. 下列各項關於原子結構之敘述,何者錯誤?
(A)原子序相同而質量數不同之元素,稱為同位素 (B)中性原子之電子數與核中之質子數相等 (C)核中質子數、中子數與電子數之總和稱為核之質量數 (D)同位素具有相同之化學性質
【答案】:(C)
【解析】:(C) 質量數是指質子數+中子數,即為原子核的核子數。
(B) 中性原子核內的質子和和外的電子數相等,因此原子不帶電。
(D)同位素有相同的質子,但是中子數不同,因此化學性質(質子數決定)相同,但是物理性質(中子數決定)不同。
( )12. 下列各種粒子中,質量最小的是那一種?
(A)氫離子 (B)氫原子 (C)電子 (D)中子 (E) a粒子
【答案】:(C)
【解析】:電子的質量僅為質子的1/1836,所以電子的質量最輕。
氫離子為氫原子失去電子,因此氫離子質量比氫原子輕。氫離子僅有1顆質子,沒有中子沒有電子,氫離子即為質子。
中子質量略大於質子,可視為相等,a粒子的質量數為4,有2個質子2個中子,質量最大。
因此四者依序為:a粒子>中子>氫原子>氫離子>電子。
( )13. 下列有質子、中子和電子的敘述,何者正確?
(A)質量最大的是質子 (B)中子不帶電,電子帶負電,質子帶正電 (C)質子最晚被發現 (D)電子的荷質比最小 (E)中子的荷質比最大
【答案】:(B)
【解析】:中子的質量略大於質子,質量比較:中子>質子>電子。
發現的順序為:電子最先,其次為質子,而中子最晚被發現。
電子的質量最小,因此核質比最大,而中子不帶電,因此核質比為0。
核質比依序為:電子>質子>中子。
( )14. 下列有關原子之敘述,何者錯誤?
(A)原子帶陽電荷或陰電荷 (B)原子核帶陽電荷 (C)失去電子成為陽離子 (D)獲得電子成為陰離子
【答案】:(A)
【解析】:原子內的質子數必等於電子數,因此原子必呈電中性,原子不帶電。
電子帶負電,失去電子則負電減少,此時質子數>電子數,成為帶正電的陽離子。
得到電子則負電增加,電子數>質子數,成為帶負電的陰離子。
( )15. 下列有關原子的敘述,何者錯誤?
(A)原子直徑約10-10 m,而原子核直徑約10-15∼10-14 m (B)原子核內含有質子和中子,質子帶正電,中子不帶電 (C)原子變成帶正電的陽離子是因原子獲得質子 (D)原子的質量大多集中在原子核
【答案】:(C)
【解析】:原子的直徑約為1埃(A),等於10-10公尺;原子核直徑約為10-15公尺。
原子帶正電,是因為失去電子,使得質子數>電子數,所以成為帶正電的陽離子。
電子的質量極輕,因此原子的質量可視為原子核的質量,可忽略電子的質量。
( )16. 下列有關原子結構的敘述,何者錯誤?
(A)質子數是判斷原子種類的依據 (B)價電子數相同的原子,化學性質相近 (C)質量數就是原子量 (D)同位素間,其質子數、原子序、電子數、電子組態均相同
【答案】:(C)
【解析】:質量數=質子數+中子數,必為整數,原子量則考慮元素的同位素,依自然界內的存在比例加權平均,因此原子量不一定為整數,可能為小數。
同位素只有中子數不相同,而質子數=原子序=核外的電子數,因此原子的電子組太會相同。
( )17. 下列有關原子構造的敘述,何者正確?
(A)原子直徑大約為10-20公尺 (B)原子核占有原子大部分體積 (C)原子的質量絕大部分集中在原子核 (D)質子和中子的數目一定相等
【答案】:(C)
【解析】:(A)原子直徑大約為10-10公尺。
(B)原子核佔有原子極小的體積,但是佔大部分的質量。
(C)正確,電子質量極小,可以忽略不計,因此原子的質量絕大部分集中在原子核。
(D)質子和中子的數合稱為質量數,但是兩者不一定相等,僅中性原子的質子數必等於電子數,而中子數則略大於或等於質子數。
( )18. 下列有關原子構造的敘述,何者正確?
(甲)原子質量均勻分布於整個原子中;(乙)原子質量絕大部分集中在原子核;(丙)電子和質子的數目一定相等;(丁)中子和質子的數目一定相等。
(A)甲丙 (B)甲丁 (C)乙丙 (D)乙丁
【答案】:(C)
【解析】:(甲)原子質量集中在原子核內,並沒有均勻分布在整個原子中,及湯姆森的原子模型為錯誤。
(乙)正確,原子質量絕大部分集中在原子核;
(丙)正確,中性原子不帶電,因此電子和質子的數目一定相等。
(丁)中子和質子的數目不一定相等,且中子數略大於質子數,原子序愈大,則中子數明顯大量增加。。
( )19. 下列何者不是陰極射線的特性?
(A)可被磁場彎曲 (B)碰到塗有螢光劑的玻璃管壁,會有螢光產生 (C)改變放電管內的氣體種類,則可改變陰極射線的性質 (D)陰極射線是具有質量的質點,會使在其通道上的薄片小風車轉動
【答案】:(C)
【解析】:(A)陰極射線帶負電,在磁場中會受到磁力作用,可被磁場彎曲。
(B)陰極射線肉眼不可見,但是碰到塗有螢光劑的玻璃管壁,會產生螢光。
(C)陰極射線的產生和玻璃管(放電管)內氣體的種類,或負極的材質無關。
(D)陰極射線是帶負電的粒子,具有質量及動能,會使在其通道上的薄片小風車轉動。
( )20. 下列何者所含電子數多於中子數?
(A) 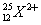 (B) (B) 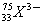 (C) (C) 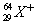 (D) (D) 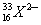 (E) (E) 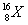 。 。
【答案】:(D)
【解析】:(A) 有12個質子,25-12=13個中子,12-2=10個電子。
(B) 有33個質子,75-33=42個中子,33+3=36個電子。
(C) 有29個質子,64-29=35個中子,33-1=32個電子。
(D) 有16個質子,33-16=17個中子,16+2=18個電子。
(E) 有8個質子,16-8=8個中子,原子不帶電,因此有8個電子。
( )21. 下列何者所具有的質子數、中子數、電子數相等?
(A) 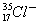 (B) (B) 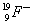 (C) (C) 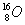 (D) (D) 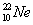
【答案】:(C)
【解析】:(A) 有17個質子,35-17=18個中子,17+1=18個電子。
(B) 有9個質子,19-9=10個中子,9+1=10個電子。
(C) 有8個質子,16-8=8個中子,原子不帶電,因此有8個電子。
(D) 有10個質子,22-10=12個中子,原子不帶電,因此有10個電子。
( )22. 下列何者為a粒子散射實驗的結論?
(A)電子以固定軌道繞質子運轉 (B)電子均勻分布在原子中 (C)原子具有一個質量集中的核心 (D)質子質量遠大於電子質量 (E)質子帶電量與電子相等,但電性相反
【答案】:(C)
【解析】:a粒子對金箔的散射實驗,發現大部分的a粒子為直線通過金箔,顯示原子內部大部分為空洞的,僅少數的a粒子有發生偏折,甚至僅極少數的a粒子呈現反彈的方向,表示原子內部有一個體積很小,但質量很大的核心。
( )23. 下列何組物質是同位素?
(A) O2與O3 (B)黃磷與赤磷 (C) 12C與13C (D)彈性硫與斜方硫
【答案】:(C)
【解析】:C-12和C-13均為碳(C),有6個質子,原子序相同,因此為同一元素,但是中子數不同,因此質量數不同。
( )24. 下列原子或離子,何者電子數與中子數相同?
(A) 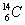 (B) (B)
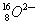 (C) (C)
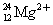 (D) (D) 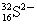
【答案】:(B)
【解析】:(A) 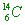 有6個質子,14-6=8個中子,原子不帶電,因此有6個電子。 有6個質子,14-6=8個中子,原子不帶電,因此有6個電子。
(B) 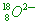 有8個質子,18-8=10個中子,8+2=10個電子。 有8個質子,18-8=10個中子,8+2=10個電子。
(C) 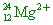 有12個質子,24-12=12個中子,12-2=10個電子。 有12個質子,24-12=12個中子,12-2=10個電子。
(D)
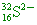 有16個質子,32-16=16個中子,16+2=18個電子。 有16個質子,32-16=16個中子,16+2=18個電子。
( )25. 下列哪一組物質是同位素?
(A)石墨、鑽石、C60 (B) 12C、13C、14C (C)葡萄糖(C6H12O6)、果糖(C6H12O6) (D) 36S、36Cl、36Ar (E) CO、CO2
【答案】:(B)
【解析】:同位素指原子序相同,有相同質子數,但是不同的中子數,因此為同一種元素,但是具有不同的質量。
石墨、鑽石、C60為同素異形體;
葡萄糖(C6H12O6)、果糖(C6H12O6)為相同分子式的化合物,但是因結構不同,因此性質不同。
36S、36Cl、36Ar為質量數相同,稱為同量素,但是不同的質子數及不同的中子數。
CO、CO2遵守倍比定律。
( )26. 下列選項中何者所含的電子數多於中子數?
(A) 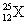 (B) (B) 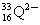 (C) (C) 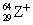 (D) (D) 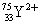
【答案】:(B)
【解析】:(A) 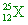 有12個質子,25-12=13個中子,原子不帶電,因此有12個電子。 有12個質子,25-12=13個中子,原子不帶電,因此有12個電子。
(B) 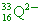 有16個質子,33-16=17個中子,電子數=16+2=18個電子。 有16個質子,33-16=17個中子,電子數=16+2=18個電子。
(C) 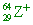 有29個質子,64-29=35個中子,電子數=29-1=28個電子。 有29個質子,64-29=35個中子,電子數=29-1=28個電子。
(D) 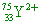 有33個質子,75-33=36個中子,電子數=33+2=35個電子。 有33個質子,75-33=36個中子,電子數=33+2=35個電子。
( )27. 下列關於原子核的敘述,何者正確?
(1)原子核只占整個原子很小的一部分體積 (2)原子核帶著原子中所有正電荷 (3)原子的大部分質量集中在原子核 (A)僅(1) (B)僅(2) (C)僅(3) (D)(1)、(2)和(3)
【答案】:(D)
【解析】:原子核內部存在著體積及小,但是質量很大的一個原子核,原子核內有質子,帶正電。
( )28. 下列關於電子、中子和原子核三者被發現的先後順序,何者正確?
(A)電子、中子、原子核 (B)中子、電子、原子核 (C)電子、原子核、中子 (D)原子核、電子、中子 (E)原子核、中子、電子
【答案】:(C)
【解析】:原子內部粒子的發現順序為:電子(最先發現)→質子→中子(最晚發現)。
( )29. 比較下列電子與質子之質量與電荷(不計電性正負)的敘述,何者正確?
(A)兩者的質量與電荷相同 (B)兩者的質量相同,但電子的電荷較小 (C)兩者的電荷相同,但電子的質量較小 (D)電子的質量與電荷都較小
【答案】:(C)
【解析】:電子與質子的電量相等,電子帶負電,質子帶正電,兩者為等量的異性電荷。
電子的質量極輕,一個質子的質量約為電子的1840倍,因此電子質量可忽略。
( )30. 比較電子、質子、中子質量大小
(A)中子>質子>電子 (B)質子>中子>電子 (C)電子>中子>質子 (D)質子>電子>中子
【答案】:(A)
【解析】:中子的質量略大於質子,但可視為約略相等,但是兩者均遠大於電子的質量,因此三者質量為:
中子>質子>電子。
( )31. 以α 粒子撞擊不同金屬薄片,則α 粒子以不同角度散射,下列何者決定此角度之大小?
(A)原子數 (B)元素之質量 (C)核電荷 (D)α 粒子之多寡
【答案】:(C)
【解析】:原子核內的正電荷數愈多,原子核對α 粒子的排斥性(靜電斥力)愈大,因此α 粒子散射產生的偏折角度也將會明顯地愈大。
( )32. 以陰極射線管實驗,證實原子中含有帶負電微粒之科學家為
(A)道耳頓 (B)拉塞福 (C)查理 (D)湯姆森
【答案】:(D)
【解析】:湯姆森在研究陰極射線時,發現陰極射線的性質和原子內所釋放的電子性質相同,因此證實原子有電子的存在,並且求得核質比(e/m)。
( )33. 甲、乙、丙、丁四種實驗,那幾種實驗的結果組合後可以決定電子質量?
甲:拉塞福的 a 粒子散射實驗;乙:湯姆森的陰極射線實驗;丙:侖琴的X射線實驗;丁:密立坎的油滴實驗。
(A)甲、乙、丙、丁 (B)甲、乙、丙 (C)乙、丁 (D)丁、丙
【答案】:(C)
【解析】:1897年,湯姆森研究陰極射線,發現電子的核質比,求得e/m=1.759x1011庫倫/公斤,
1909年,密立坎的油滴實驗,測得電子的帶電量為1.602x10-19庫侖,因此將電子電量代入核質比(e/m),間接求得電子的質量為9.1x10-31公斤。
( )34. 同族元素由上而下,哪一項敘述錯誤?
(A)原子序漸大 (B)原子半徑漸大 (C)價電子漸多 (D)已填滿之軌域漸多
【答案】:(C)
【解析】:同一族的元素化學性質相類似,但在週期表由上而下,隨著原子序的增加,原子核內的質子數目愈多,核外的電子數也愈多,因此原子的半徑也愈大,但是最外層的價電子數目則相同。
隨著週期表內元素的週期增加,內層的束縛電子數目(填滿的電子軌域)明顯愈多。
( )35. 在下列幾種微粒子中,已知a、b、c不相等,則其中互為同位素的是
(A) W和Y (B) W和Z (C) Z和P (D) W和Q
【答案】:(A)
【解析】:同位素指原子序相同,有相同的質子數,因此元素符號左下角的數目需相同。
因此只有(A) 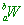 和 和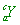 為同位素,有相同的質子數目。 為同位素,有相同的質子數目。
( )36. 在氯原子(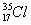 )中,質子數、中子數及質量數各為多少? )中,質子數、中子數及質量數各為多少?
(A) 17、18、35 (B) 18、17、35 (C) 17、17、18 (D) 18、18、17
【答案】:(A)
【解析】: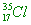 的原子序為17,有17個質子,中子數=35-17=18個中子,質量數為元素符號的左上角=35,中性原子的電子數=質子數=17個電子。 的原子序為17,有17個質子,中子數=35-17=18個中子,質量數為元素符號的左上角=35,中性原子的電子數=質子數=17個電子。
( )37. 有關拉塞福原子模型的敘述何者錯誤?
(A)原子由原子核與核外電子組成 (B)電子以圓形軌道繞原子核運轉 (C)原子核帶正電 (D)原子核的質量幾乎等於原子質量 (E)原子核占有原子大部份空間
【答案】:(E)
【解析】:(E)錯誤,原子核站的體積極小,因此原子內部大部分為空空洞洞。
(B)正確,電子在原子核外圍,繞著原子核旋轉,原子的大小,即為電子在原子的四周存在的範圍。
( )38. 有關原子結構的敘述,下列何者有誤?
(A)原子中大部分質量集中於原子核內 (B)相同元素之原子具有相同的電子數 (C)相同元素之原子具有相同的質量數 (D)原子可獲得或失去一個電子,而其核電荷仍不變
【答案】:(C)
【解析】:(A)原子中大部分質量集中於原子核內 (B)相同元素之原子具有相同的電子數 (C)相同元素之原子具有相同的質量數 (D)原子可獲得或失去一個電子,而其核電荷仍不變
( )39. 有關電子、中子、質子的敘述,哪些正確?
(A)電子最早被發現,而質子最晚 (B)三種粒子在電場和磁場中皆會有偏折現象發生 (C)質量大小次序為中子>質子>電子 (D)電子數=質子數=中子數 (E)原子核皆由質子與中子所組成
【答案】:(C)
【解析】:(A)電子最早被發現,質子其次,中子最晚被發現。
(B)質子和電子有帶電,在電廠和磁場中會受力產生偏向,但是中子不帶電,沒有偏折現象發生。
(C)正確,質量大小次序為中子>質子>電子。
(D)電子數=質子數,但不一定等於中子數,原子序愈大時,中子數目會明顯地大於質子數。
(E)氫原子核只有1個質子,但是沒有中子,因此原子內不一定有中子。
( )40. 自然界之某元素 X,下列其各種數據之敘述最為正確的是:
(A)原子序11.2 (B)質量數23.2 (C)原子量23.2 (D)電子數11.2
【答案】:(C)
【解析】:原子序等於質子數,必為整數;質量數=質子數+中子數,亦為整數;
電子不能被分割,因此電子數必為整數。
原子量包含同位素所佔的比例,因此同位素一存在比例加權平均,因此原子量可以有小數。
( )41. 某金屬元素(M)的質量數為55,而其二價陽離子(M2+)具有23個電子,則此金屬元素原子核內含有幾個中子?
(A) 30 (B) 23 (C) 32 (D) 34
【答案】:(A)
【解析】:二價陽離子(M2+)具有23個電子,因此質子數比電子數多2個,才能帶正電,因此質子數=23+2=25個質子。
中子數=質量數-質子數=55-23=32個中子。
( )42. 若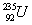 的原子核放射出一個a粒子後,則原子核內含有幾個質子? 的原子核放射出一個a粒子後,則原子核內含有幾個質子?
(A) 237 (B) 236 (C) 146 (D) 91 (E) 90
【答案】:(E)
【解析】: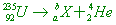 92=a+2 a=90 235=b+4 b=231
92=a+2 a=90 235=b+4 b=231
質子數等於原子序,因此放射後的原子核質子數=a=90個。
( )43. 原子、離子或分子經常是化學討論的粒子,試比較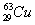 與 與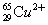 兩種粒子,下列選項中何種數值,兩者相同? 兩種粒子,下列選項中何種數值,兩者相同?
(A)電子數 (B)中子數 (C)質子數 (D)質量數 (E)安定性
【答案】:(C)
【解析】: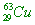 與 與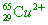 兩種粒子,為同位素,有相同的質子,皆為29個質子,有不同的中子數, 兩種粒子,為同位素,有相同的質子,皆為29個質子,有不同的中子數,
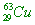 有質子29個,中子數=63-29=34個,原子不帶電,電子數=質子數=29個。 有質子29個,中子數=63-29=34個,原子不帶電,電子數=質子數=29個。
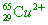 有質子29個,中子數=65-29=36個,原子帶2個正電,所以電子少2個, 有質子29個,中子數=65-29=36個,原子帶2個正電,所以電子少2個,
電子數=29-2=27個電子。
( )44. 原子的直徑很小,約為:
(A)10-7 m (B)10-8 m (C)10-9 m (D)10-10 m
【答案】:(D)
【解析】:原子的直徑約為10-10公尺,約為1埃(A)。
( )45. 原子是直徑約10-10公尺的微小粒子,下列有關原子的敘述,何者錯誤?
(A)中性原子的核外電子數與核內質子數相等 (B)原子的質量大部份集中在原子核 (C)原子核佔有原子大部份的體積 (D)原子的原子序等於原子核內的質子數
【答案】:(C)
【解析】:(C)原子核僅佔有原子極小部分的體積,但是具有大部份的質量。
( )46. 原子量為1的氫原子,含有哪些基本粒子?
(A)電子、中子 (B)質子、中子 (C)質子、電子 (D)質子、中子、電子
【答案】:(C)
【解析】:原子量為1的氫原子,可以表示成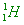 ,H原子的質子有1個,電子有1個,質量醋為1,中子數=1-1=0,因此H原子沒有中子。 ,H原子的質子有1個,電子有1個,質量醋為1,中子數=1-1=0,因此H原子沒有中子。
H原子內只有1個質子和外圍有1個電子。
( )47. 根據湯姆森荷質比實驗及密立坎油滴實驗的結果可推算下列哪一項性質?
(A)電子的質量 (B)中子的質量 (C)質子的質量 (D)電子的電量 (E)質子的電量
【答案】:(A)
【解析】:湯姆森荷質比實驗可以求得e/m的比值,而密立坎的油滴實驗,則可以直接得到電子的電量,由電子的電量代入核質比(e/m),間接求得電子的質量。
( )48. 氣體放電管中,由陰極(負極)發射出來的電子束叫做:
(A)陰極射線 (B)陽極射線 (C) X光 (D)α射線
【答案】:(A)
【解析】:氣體放電管中,由陰極(負極)發射出來的電子束叫做陰極射線。
實驗發現,在低氣壓高電壓時,陰極射線由負極射向正極,陰極射線與陰極的材料無關,與玻璃管內填充的氣體無關,為高速帶負電的電子流。
( )49. 密立坎的油滴實驗是為了測量下列哪一項性質?
(A)電子的質量 (B)質子的質量 (C)中子的質量 (D)電子的電量 (E)質子的質量
【答案】:(D)
【解析】:密立坎的油滴實驗利用顯微鏡觀察油滴的帶電情形,假設油滴所帶的電量有最小單位,並且電荷不能分割,因此測得電子的電量為1.602x10-19庫侖。。
( )50. 荷質比是粒子電荷量與質量的比值絕對值,則下列何種粒子的荷質比最小?(原子量:I=127)
(A)電子 (B)質子 (C)中子 (D) a 粒子 (E)碘離子
【答案】:(C)
【解析】:核質比最小請找電荷數目最少,質量最大的粒子。
電子=e/(1/1840amu) 質子=e/1amu
中子的電荷為0,因此核質比=0;
a 粒子(氦原子核)=2e/4amu 碘離子(I-離子)=e/131amu
中子的核質比=0為最小。
( )51. 僅依據密立坎(Millikan)油滴實驗可決定電子的下列何種性質?
(A)質量( m ) (B)質量與電荷比( m/e ) (C)電荷( e ) (D)能量( E )
【答案】:(C)
【解析】:密立坎(Millikan)油滴實驗可決定電子的電荷量=1.602x10-19庫侖。
( )52. 溴的原子序為35,已知溴存在兩個同位素,其百分率幾近相同,而溴的原子量為80,則溴的兩個同位素中的中子數分別為何?
(A) 43和45 (B) 79和81 (C) 42和44 (D) 44和46 (E) 45和47
【答案】:(D)
【解析】:溴的原子序為35,兩種同位素分別為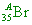 和 和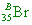 ,其中Ax0.5+Bx0.5=80, ,其中Ax0.5+Bx0.5=80,
因此 A+B=160,而A內的中子數X=(A-35),B內的中子數Y=B-35,
A+B=A+B-35-35=160-70=90 因此只有(D)符合。
( )53. 可作放射性治療用,下列關鈷六十的原子結構,何者正確?
(A) 60Co有27個電子 (B) 60Co有60個中子 (C) 60Co3+有30個中子 (D) 60Co3+有33個質子
【答案】:(A)
【解析】:鈷六十(原子序27)可表示成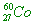 ,其中質子數=27個,中子數=60-27=33個,原子不帶電,因此電子數=27個。 ,其中質子數=27個,中子數=60-27=33個,原子不帶電,因此電子數=27個。
( )54. 遠在發現原子中有帶負電荷的「電子」之前,何人發現了原子和電荷間的關係?
(A)道耳頓 (B)法拉第 (C)密立坎 (D)湯姆森
【答案】:(B)
【解析】:(A)道耳頓提出原子說;
(B)法拉第提出電解定律,說明電解時通入電量與析出物質量的關係;
(C)密立坎利用油滴實驗求得電子電量; (D)湯姆森求得電子之核質比(e/m)值。
電解1莫耳的電量需96500庫侖,稱為1法拉第。
( )55. 請問Br原子(原子序35)有幾個價電子?
(A) 1 (B) 5 (C) 7 (D) 35
【答案】:(C)
【解析】:稀有氣體是最完美的氣體,電子軌域全部填滿,Br為第四週期的鹵族元素,在最外層的價電子,有7個價電子。
( )56. 關於科學家在原子領域的研究,下列敘述何者錯誤?
(A)拉塞福發現原子核中具有質子與中子 (B)湯姆森證實電子的存在 (C)道耳頓提出原子說 (D)粒子的發現時間順序:電子→質子→中子 (E)拉塞福認為原子的質量絕大部分集中在原子核
【答案】:(A)
【解析】:(A) 拉塞福未發現中子。
(B) 湯姆森研究陰極射線,發現電子的存在。
(C) 道耳頓提出原子說,解釋定比定律、倍比定律、質量守恆定律,但不能解釋有關分子的定律。
(D) 原子內部的粒子發現:電子(最先)其次為質子,中子為最晚發現。
(E) 拉塞福以α粒子的金箔散射實驗,提出原子內部為空空洞洞,存在一個體積極小,但質量很大的原子核。
( )57. 關於原子結構的敘述,何者正確?
(A)所有原子核中都有中子 (B)中子的質量稍大於質子 (C)原子核內中子數必大於質子數 (D)原子核半徑約為10-15∼10-14公尺且1個電子的質量為1.6×10-19公斤
【答案】:(B)
【解析】:(A)氫原子沒有中子,只有1個質子。
(B)正確,中子的質量略大於質子的質量。
(C)原子核內的中子數一般大於等於質子數目,當原子序愈大時,中子數明顯增加。
(D)1個電子的電量為1.602x10-19庫侖,1個電子的質量=9.1x10-31公斤。
( )58. 關於密立坎油滴實驗之敘述,何者正確?
(A)油滴上所帶電荷只有正、負其中一種 (B)油滴帶電荷大小均為1.6×10-19庫侖 (C)利用X-ray照射使油滴帶電 (D)目的在測電子之荷質比
【答案】:(C)
【解析】:密立坎油滴實驗之敘述,是利用噴霧器製造細小的油滴,再以X光照射,使形成帶電的油滴,再調整外加電板的電壓,使油滴所帶的電量和重量相抵消,求得帶電油滴所帶的最小電量,即為1個電子的電量。
( )59. 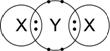 X、Y兩元素形成如附圖的化合物(僅顯示X、Y之最外層而已),則下列敘述何者正確? X、Y兩元素形成如附圖的化合物(僅顯示X、Y之最外層而已),則下列敘述何者正確?
(A)此化合物是簡單的共價分子化合物,因此室溫時為氣體 (B)因Y是碳,X是氧,故此圖為CO2的結構 (C) Y為ⅥA族元素 (D) X為ⅡA族元素
【答案】:(C)
【解析】:圖中,XY分別提出一個價電子,兩原子共用一對價電子,因此X有1個價電子,Y則有6個價電子,所以X為正1價,Y則為-2價的元素,所以Y可能為ⅥA族元素(O、S…)。
( )60. 1911年提出核原子模型之科學家為:
(A)道耳頓 (B)拉塞福 (C)查理 (D)湯姆森
【答案】:(B)
【解析】:拉塞福進行金箔的散射實驗,發現原子內部為空空洞洞,僅有一個體積極小,質量很大的核,因此在1911年拉塞福提出原子的行星模型。
( )61. 2002年的諾貝爾化學獎由Wuthrich等三人獲得,他的貢獻在於改善核磁共振(NMR)技術,證明它也可以用來研究生物巨分子如蛋白質、DNA的構造,例如13C-NMR與15N-NMR。下列有關13C與15N的敘述,何者正確?
(A)二者具相同的質子數 (B)二者具相同的中子數 (C) 13C與C60為同素異形體 (D) 14N2與15N2化性相同
【答案】:(D)
【解析】:
( )62. 39K(原子序19)元素的活性大,與水反應會產生H2,下列關於39K的原子結構之敘述,何者正確?
(A) 39K有39個電子 (B) 39K有39個中子 (C) 39K
+有20個中子 (D) 39K
+有20個質子
【答案】:(C)
【解析】:
( )63. CH4=16克/莫耳。1.6克12C1H4中組成的基本粒子總數為:
(A)質子、中子、電子各為0.10莫耳 (B)質子、中子、電子各為1.0莫耳 (C)質子1.0莫耳、中子0.6莫耳、電子1.0莫耳 (D)質子0.6莫耳、中子1.2莫耳、電子1.2莫耳 (E)質子1.2莫耳、中子1.2莫耳、電子0.6莫耳
【答案】:(C)
【解析】:
( )64. Na+離子可能具有下列各組粒子組合之一,其組合以(質子數,中子數,電子數)表示,應為:
(A)(10,11,12) (B)(10,12,11) (C)(11,11,12) (D)(11,12,10)
【答案】:(D)
【解析】:
( )65. X2+與Y-都具有18個電子及20個中子,下列有關X、Y兩元素的敘述何者有誤?
(A) X之質量數為40 (B) X和Y為同一列元素 (C) X2+和Y-的價電子數相等 (D) X2+和Y-兩者與氬氣的總電子數相等
【答案】:(B)
【解析】:
( )66. XO42-中有59個電子,則55X之中子數為多少個?
(A) 26 (B) 28 (C) 30 (D) 32
【答案】:(C)
【解析】:
( )67. 一莫耳原子的質量若以克表示,並取其最接近的整數值,此整數值和該原子的什麼相等?
(A)原子序 (B)質子數 (C)中子數 (D)質量數
【答案】:(D)
【解析】:
( )68. 下列有關氧原子和他種原子之間不同處的敘述,哪項錯誤?
(A)氧原子核與他種原子核,各具有不同的質子數 (B)氧原子核內中子數對質子數的比率,較他種原子核為高 (C)中性氧原子具有與他種中性原子不同的電子數 (D)氧原子和他種原子,各具不同的化學行為
【答案】:(B)
【解析】:
( )69. 下列有關電子的敘述,何者正確?
(A)在湯姆森的陰極射線實驗中,可證明電子具有波動性 (B)電視影像是由電子槍射出電子束,掃描到螢光幕而形成 (C) Ra衰變成Rn所放出的射線為電子 (D)電子的e/m值為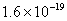 庫侖/克 庫侖/克
【答案】:(B)
【解析】:
( )70. 下列有關質子的敘述,何者有誤?
(A)1莫耳質子之電量為96500庫侖 (B)每個質子帶+1電荷 (C)質子均勻分布於電子群中 (D)每個質子帶1.60×10-19庫侖電量
【答案】:(C)
【解析】:
( )71. 下列哪一組物質是屬於同位素的關係?
(A)石墨與鑽石 (B)水與重水 (C)白磷與赤磷 (D) 12C和14C
【答案】:(D)
【解析】:
( )72. 下列對同位素之敘述,何者正確?
(A)質子數相等,中子數不等,化性不同 (B)質子數相等,中子數不等,化性相同 (C)質子數與中子數均相等,電子數不等,化性亦不同 (D)質子數不等,中子數與價電子數相等,化學性質相同
【答案】:(B)
【解析】:
( )73. 下列關於原子結構的敘述,何者正確?
(A)質子是查兌克以α粒子撞擊鈹核而發現 (B)中子質量比質子質量稍大 (C)原子核的直徑約10-10公尺 (D)同位素的中子數相同而質量數不同
【答案】:(B)
【解析】:
( )74. 已知56Fe3+有23個電子,則其質子數、中子數分別為何?
(A) 22,56 (B) 23,33 (C) 23,56 (D) 26,30
【答案】:(D)
【解析】:
( )75. 已知元素A其原子序為92,質量數為235,則其原子核內的質子數為若干?
(A) 92 (B) 114 (C) 143 (D) 235
【答案】:(A)
【解析】:
( )76. 已知自然界中B占20%、B占80%;則下列何者為硼之平均原子量?
(A) 10.2 (B) 10.5 (C) 10.8 (D) 10.9
【答案】:(C)
【解析】:
( )77. 已知某種鐵的同位素離子Fe3+比鈣原子多出三個電子,且其原子之中子數亦較電子數多出三個,則該原子的質子數、質量數分別為何?
(A) 20,43 (B) 23,49 (C) 26,55 (D) 26,56
【答案】:(C)
【解析】:
( )78. 已知氧有三種同位素16O、17O、18O,則O2會有幾種不同的分子量?
(A) 3 (B) 4 (C) 5 (D) 6 (E) 9
【答案】:(C)
【解析】:
( )79. 已知硼原子的質量為10.81 amu,硼原子乃由原子量為10.01的10B和原子量為11.01的11B兩種同位素所組成,則10B所占硼原子的百分率為下列何者?
(A) 20% (B) 30% (C) 70% (D) 80%
【答案】:(A)
【解析】:
( )80. 元素的化學性質主要取決於原子的
(A)質量數 (B)中子數 (C)近核內層電子數 (D)最外層電子數
【答案】:(D)
【解析】:
( )81. 天然的氯35Cl及37Cl兩種同位素,氯原子的平均原子量為35.5,則兩種同位素在自然界中的含量比為何?
(A) 5:1 (B) 3:1 (C) 1:1 (D) 2:1
【答案】:(B)
【解析】:
( )82. 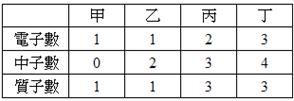 甲、乙、丙、丁為原子或離子,其所含質子、中子與電子的數目如下表,依附表數據,下列敘述何者錯誤? 甲、乙、丙、丁為原子或離子,其所含質子、中子與電子的數目如下表,依附表數據,下列敘述何者錯誤?
(A)甲之中子數為0,自然界中不可能存在 (B)甲、乙為同位素 (C)丙為離子 (D)甲-與丁+具有相同的電子排列(E)甲、乙化學性質相同
【答案】:(A)
【解析】:
( )83. 目前已知原子序最大的元素是在西元1998年,由俄羅斯科學家利用一個鈣原子與一個鐠原子融合而成的 Uuq。下列有關此最新元素的敘述,何者正確?
(A) Uuq的原子序為175 (B)
Uuq的電子數目為289 (C)
Uuq原子核中有423個中子 (D)
Uuq原子核中有114個質子
【答案】:(D)
【解析】:
( )84. 在NH4+中(N之質量數為14)共含有
(A) 7個中子、7個質子、6個電子 (B) 5個中子、5個質子、4個電子 (C) 7個中子、11個質子、10個電子 (D) 7個中子、11個質子、11個電子
【答案】:(C)
【解析】:
( )85. 原子序1~18的元素中,原子只有一個不成對電子的元素共有幾個?
(A) 4 (B) 5 (C) 6 (D) 7
【答案】:(D)
【解析】:
( )86. 在陰極射線管的實驗中,兩極所通的電壓、管中氣體呈現的氣壓分別為:
(A)高電壓、高氣壓 (B)高電壓、低氣壓 (C)低電壓、高氣壓 (D)低電壓、低氣壓
【答案】:(B)
【解析】:
( )87. 如果以原子為組成物質的單元,則直徑為0.1毫米的一粒細砂含有的原子數目約為多少?
(A) 106 (B) 109 (C) 1013 (D) 1017(選最接近的數量級)
【答案】:(D)
【解析】:
( )88. 如果銅元素的原子量是63.5,則自然界中銅的同位素6329Cu和6529Cu之原子個數比為何?
(A) 3:1 (B) 1:3 (C) 4:1 (D) 1:4
【答案】:(A)
【解析】:
( )89. 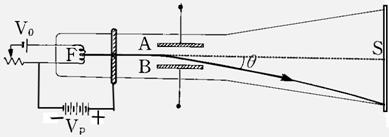 如圖,映像管中陰極射線從燈絲F出發,經加速電壓VP加速後,受兩金屬板A、B間靜電場的偏折而射向螢光幕S。則映像管內的氣壓應如何調整,才能達到較佳的映像效果? 如圖,映像管中陰極射線從燈絲F出發,經加速電壓VP加速後,受兩金屬板A、B間靜電場的偏折而射向螢光幕S。則映像管內的氣壓應如何調整,才能達到較佳的映像效果?
(A)增高管內氣壓,提供較多的空氣分子,以增多陰極射線的粒子數 (B)減低管內氣壓,以降低陰極射線與空氣子的碰撞機會 (C)增高管內氣壓,提供較大的壓力,以增強陰極射線的能量 (D)調整管內氣壓,不影響映像管的映像效果。
【答案】:(B)
【解析】:
( )90. 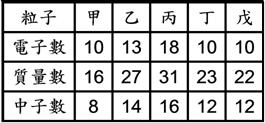 有甲∼戊五種粒子,其組成如附表所示:有關此五種粒子的敘述,何者正確? 有甲∼戊五種粒子,其組成如附表所示:有關此五種粒子的敘述,何者正確?
(A)中性原子有2個,陽離子有1個,陰離子有2個 (B)中性原子有1個,陽離子與陰離子各有2個 (C)陽離子有2個,陰離子有3個 (D)中性原子有2個,陰離子有3個 (E)中性原子有3個,陽離子有2個。
【答案】:(A)
【解析】:
( )91. 有關 X(X表某一元素之元素符號)敘述,下列何者錯誤?
(A) Z值可決定該中性原子化學性質 (B) A、Z均可為正整數 (C) A值就是該原子的原子量 (D) X、X稱為同位素(A≠B)
【答案】:(C)
【解析】:
( )92. 有關拉塞福之原子模型及使用「α粒子」束撞擊金屬箔的何項敘述錯誤?
(A)極大多數之「α粒子」可以射穿金屬而不偏轉 (B)「α粒子」之偏轉角度沒有超過150°的 (C)「α粒子」和原子核都帶正電荷,故互相排斥而使前者偏轉 (D)原子核幾乎含有全部之原子質量
【答案】:(B)
【解析】:
( )93. 有關原子與原子量的敘述,下列何者正確?
(A)原子可由肉眼加以辨識 (B)原子量為一個原子的實際質量 (C)原子量有單位 (D)原子量目前是採用質量數為12的碳原子作為標準
【答案】:(D)
【解析】:
( )94. 拉塞福(Rutherford)用α粒子撞擊金箔的實驗,測出:
(A) e/m之數值 (B)α粒子之電荷 (C)原子之質量 (D)原子核之存在
【答案】:(D)
【解析】:
( )95. 拉塞福用α粒子射向金箔,發現:
(A)大部分的粒子被偏轉了 (B)少部分粒子被偏轉,但偏轉的程度很小 (C)大部分粒子被偏轉,但偏轉程度很小 (D)很少的粒子被偏轉,但偏轉的角度很大
【答案】:(D)
【解析】:
( )96. 拉塞福在1919年以 a 粒子(He)撞擊氮原子核(N),產生核反應。若該反應產生的兩種粒子,有一為氧原子核(O),則另一粒子為何?
(A)電子 (B)中子 (C)質子 (D) a粒子 (E)鈹原子核(Be)
【答案】:(C)
【解析】:
( )97. 拉塞福的α粒子散射實驗,所得的結論是:
(A)α粒子可以穿透金屬箔 (B)α粒子的能量很大 (C)α粒子與電子相撞而不反彈 (D)原子分原子核及電子兩部分
【答案】:(D)
【解析】:
( )98. 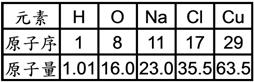 右表是一些元素的原子序及原子量:在等質量的氫氣、水、食鹽、銅中,何者具有較多的電子? 右表是一些元素的原子序及原子量:在等質量的氫氣、水、食鹽、銅中,何者具有較多的電子?
(A)氫氣 (B)水 (C)食鹽 (D)銅
【答案】:(A)
【解析】:
( )99. 某一金屬陽離子M3+,已知它具有28個電子,且質量數為70,則下列敘述何項錯誤?
(A) M原子序為28 (B) M之原子核電荷為+31 (C) M之原子核中其中子數為39 (D) M之原子核中其質子數為31。
【答案】:(A)
【解析】:
|





