|
一、單選題:
( )1. 今有兩種不同元素X及Y,化合為兩個含此兩種元素的化合物。第一個化合物是由9.34克的X和2.00克的Y化合而成;而第二個化合物是由4.67克的X和3.00克的Y化合而成。如果第一個化合物的分子式是XY,那麼第二個化合物的分子式為下列何者?
(A) (B) (B) (C) (C) (D) (D) (E) (E) 。【96學測】 。【96學測】
【答案】:(D)
【解析】:
  
將B化合物的質量x2,得到AB化合物,有相同質量的X,但是Y的質量比2:6=1:3。
因此A化合物的化學式為XY,則B化合物的化學式應為XY3。
(
)2.
小華進行了一個簡單的實驗,以測定金屬M之原子量。他將該金屬之氧化物(化學式 )1.6克在高溫下分解,剩下的金屬質量為1.12克,則M之原子量為多少? )1.6克在高溫下分解,剩下的金屬質量為1.12克,則M之原子量為多少?
(A)28 (B)42 (C)56 (D)70 (E)84。【92學測】
【答案】:(C)
【解析】:2M2O3à4M+3O2 M氧化物分解成M和氧氣,1.6克=1.12克+X
è X=0.48克
M:O=   M=56。 M=56。
(
)3.
下列哪一組化合物有倍比定律關係?
(A) 、 、 、 、 (B) (B) 、 、 、 、 (C) (C) 、 、 、 、 (D) (D) 、 、 、 、 。 。
【答案】:(C)
【解析】:兩種元素,組成不同的化合物,若固定其中一元素的質量,則另一元素的質量成簡單整數比,稱為倍比定律。
(C)C和H組成CH4、C2H4、C3H6,若固定C的質量成為C6H24、C6H12、C6H12
,則H的質量比=24:12:12=2:1:1,遵守倍比定律。
( )4.
已知亞佛加厥數為 ,下列哪一項所含氫的原子數最多? ,下列哪一項所含氫的原子數最多?
(A) 個氫分子中的氫原子 (B) 個氫分子中的氫原子 (B) 個磷酸分子中的氫原子 (C)8.5克氨所含的氫原子 (D)8克甲烷所含的氫原子。【北一女中】 個磷酸分子中的氫原子 (C)8.5克氨所含的氫原子 (D)8克甲烷所含的氫原子。【北一女中】
【答案】:(D)
【解析】:(A) 個氫分子= 個氫分子= 氫分子,含有1莫耳氫原子。 氫分子,含有1莫耳氫原子。
(B) 個磷酸(H3PO4)分子= 個磷酸(H3PO4)分子= H3PO4分子, H3PO4分子,
含有0.25x3=0.75莫耳的氫原子
(C)8.5克氨(NH3)= NH3分子,含有0.5x3=1.5莫耳氫原子。 NH3分子,含有0.5x3=1.5莫耳氫原子。
(D)8克甲烷(CH4)= CH4分子,含0.5x4=2.0莫耳氫原子。 CH4分子,含0.5x4=2.0莫耳氫原子。
(
)5.
下列關於「莫耳」的敘述,何者正確?
(I)1克的氫原子約有 個質子 個質子
(II)23克的鈉金屬約含1莫耳的原子
(III)全球人口總數大約是 莫耳的人(目前全球人口大約六十億) 莫耳的人(目前全球人口大約六十億)
(IV)全球每年增加的電腦數超過 莫耳臺電腦 莫耳臺電腦
(A)I與III是正確的 (B)II與IV是正確的 (C)I、II與III是正確的 (D)四個敘述都是錯誤的。【92學測預試】
【答案】:(C)
【解析】:(I )氫原子量=1,1克的氫原子=1莫耳的氫原子,約有 個原子, 個原子,
而1個氫原子中含˙有1個質子,因此共有6x1023個質子。
(II) Na原子量=23,1莫耳鈉=23克,因此23克的鈉金屬約含1莫耳的原子。
(III) 全球人口總數約60億=6x109人= 莫耳的人。 莫耳的人。
(IV) 1x10-4莫耳台電腦=1x10-4x(6x1023)=6x1019台電腦,數字太大,
一年中全球每年增加的電腦數不可能達到。
(
)6.
下列有關物質「數量」的敘述,何者正確?
(A)在同溫、同壓時,1升的氦與1升的氫所含的原子數目相同 (B)22.4升的氧氣中含有 個氧分子 (C)在同溫、同壓時,同體積的任何物質皆含有相同數目的分子 (D)在STP時,若二氧化碳與甲烷所含的原子數目相同,則體積比為5:3。 個氧分子 (C)在同溫、同壓時,同體積的任何物質皆含有相同數目的分子 (D)在STP時,若二氧化碳與甲烷所含的原子數目相同,則體積比為5:3。
【答案】:(D)
【解析】:(A)
同溫、同壓時,1升的氦與1升的氫所含的分子數目相同,但是原子數目不同。
(B) 只有在0℃、1atm下,22.4升的氧氣=1莫耳的氧氣,才含有 個氧分子。 個氧分子。
(C) 同溫、同壓時,同體積的任何”氣體”,含有相同數目的分子。
(D) 二氧化碳(CO2)一個分子有3個原子,甲烷(CH4)1個分子有5個原子,若原子數目相同,則CO2需有5個分子,CH4需有3個分子,所以分子數比=5:3,體積比=5:3。
( )7.
同溫同壓下,若25 mL的氮氣分子含A個原子,則多少mL的甲烷亦含有A個原子?
(A)62.5 (B)50 (C)25 (D)10。【師大附中】
【答案】:(D)
【解析】:25 mL的氮氣(N2)分子含A個原子,有 個分子, 個分子,
CH4中含有A個原子,則僅有 個分子,所以 個分子,所以
兩者體積比=分子數比= X=10mL。 X=10mL。
( )8.
元素甲有三種天然同位素,其原子量分別為 ,A, ,A, ,若天然元素甲之平均原子量為A,則原子量 ,若天然元素甲之平均原子量為A,則原子量 的同位素最大含量不能超過多少百分率? 的同位素最大含量不能超過多少百分率?
(A)60 (B)50 (C)45 (D)25 %。【師大附中】
【答案】:(A)
【解析】:假設(A-2)的含量佔x,(A+3)的含量佔y,則A的含量佔(1-x-y),
(A-2)x+A(1-x-y)+(A+3)y=A Ax-2x+A-Ax-Ay+Ay+3y=A
2x=3y x:y=3:2,所以X最多佔3/5,y最多佔2/5,
因此(A-2)的含量最多佔60%。
( )9.
自然界中存有氖 和氖 和氖 ,而氖的平均原子量為20.2,由此推知氖 ,而氖的平均原子量為20.2,由此推知氖 在自然界中含量約為多少? 在自然界中含量約為多少?
(A)1% (B)5% (C)10% (D)20% (E)30%。【成功高中】
【答案】:(C)
【解析】:Ne-20佔x,Ne-22佔(1-x),則20x+22(1-x)=20.2
1.8=2X X=0.9=90% 所以Ne-20佔90%,Ne-22佔10%。
( )10.
已知 的三種同位素其中子數分別為14、15、16,且其原子量為28.09,則何種同位素的含量最多? 的三種同位素其中子數分別為14、15、16,且其原子量為28.09,則何種同位素的含量最多?
(A) (B) (B) (C) (C) (D) (D) 。【臺中女中】 。【臺中女中】
【答案】:(A)
【解析】:Si的質量數分別為28、29、30,平均原子量接近28時,表示28Si的含量佔最多,平均原子量接近29時,表示29Si的含量佔最多;平均原子量接近30時,表示30Si的含量佔最多。
(
)11. 有關原子與分子,下列各項敘述,何者錯誤?
(A)分子由原子所構成,且分子內之原子個數為整數 (B)物質的性質由其所含之原子種類、數目及排列方式決定 (C)組成物質的原子種類不相同,物質的性質不同 (D)分子化合物中組成的原子種類及數目相同,則化合物的性質相同。
【答案】:(D)
【解析】:分子化合物中組成的原子種類及數目相同,由於結構排列不一定相同,因此化合物的性質不一定會相同。
( )12.
在同溫同壓時,同重的硫化氫( )氣體和氨氣( )氣體和氨氣( ),下列何項中硫化氫:氨 ),下列何項中硫化氫:氨 2:1?(S 2:1?(S 32,N 32,N 14) 14)
(A)分子數比 (B)體積比 (C)單一分子重量比 (D)原子數比。【高雄女中】
【答案】:(C)
【解析】:H2S的分子量=34,NH3的分子量=17;因此同溫、同壓下,等重的硫化氫(H2S)氣體:氨氣(NH3)= ,所以莫耳數比=1:2=分子數比=體積比。 ,所以莫耳數比=1:2=分子數比=體積比。
單一分子重量比=分子量比=34:17=2:1。
(
)13. 某氣體2.0升重4.6克,同溫、同壓下的氧氣4.0升重6.4克,則此氣體可能為何?(原子量:N 14,O 14,O 16,S 16,S 32) 32)
(A)CO2 (B)NO2 (C)SO2 (D)N2O4。
【答案】:(B)
【解析】:某氣體2.0升重4.6克,因此4.0升重9.2克,同溫、同壓下的氧氣4.0升重6.4克,因此體積相同,莫耳數相同,質量比=分子量比
9.2:6.4=M:32 M=46 所以為NO2氣體。
( )14.
某物質 克中含 克中含 個分子,則該物質的分子量為若干? 個分子,則該物質的分子量為若干?
(A)30 (B)60 (C)300 (D)600。【成功高中】
【答案】:(A)
【解析】:某物質 克中含 克中含 個分子,所以 個分子,所以
M=3x10=30。
(
)15. 室溫下,反應 ,反應前後之體積變化量,何者正確? ,反應前後之體積變化量,何者正確?
(A) :HCl: :HCl: 1:1:1 (B)僅知 1:1:1 (B)僅知 :HCl :HCl 1:1 (C)僅知 1:1 (C)僅知 : : 1:1 (D)僅知HCl: 1:1 (D)僅知HCl: 1:1。 1:1。
【答案】:(B)
【解析】:NH4Cl為固體,不遵守氣體反應體積定律,因此只有NH3:HCl=1:1。
(
)16. 每一個原子質量單位(amu)等於下列何項?
(A)C原子質量的 (B)O原子質量的 (B)O原子質量的 (C) (C) 原子質量的 原子質量的 (D)H原子質量。 (D)H原子質量。
【答案】:(C)
【解析】:1個核子包含質子或中子,1個質子質量=1個中子質量=1amu,
碳(12C)原子量為12,1個12C原子的質量有12amu,
或是氧(16O)原子量為16,1個16O原子的質量有16amu。
( )17.
假設有一超重的元素,原子序120被發現在木星,由於非常稀罕,僅能分離得 個原子,並稱量此樣品只有 個原子,並稱量此樣品只有 克,則該原子1個的質量為若干amu? 克,則該原子1個的質量為若干amu?
(A)1∼100 (B)100∼250 (C)250∼400 (D) 400。【臺中二中】 400。【臺中二中】
【答案】:(C)
【解析】: ,1amu=1.67x10-24克 該原子質量= ,1amu=1.67x10-24克 該原子質量= amu,所以約為250∼400amu。 amu,所以約為250∼400amu。
( )18.
A、B兩元素在不同條件下化合,可得AB及 兩種化合物,已知含A之重量百分率依次為x%及y%,則下列關係式何者正確? 兩種化合物,已知含A之重量百分率依次為x%及y%,則下列關係式何者正確?
(A) (B) (B) (C) (C) (D) (D) 。【臺中一中】 。【臺中一中】
【答案】:(B)
【解析】:  兩化合物有相同的B元素,則A元素的質量比= 兩化合物有相同的B元素,則A元素的質量比=
2y(100-x)=3x(100-y) è 200y-2xy=300x-3xy
200y=300x-xy=x(300-y) è

(
)19. (甲)一個銅原子;(乙) 莫耳的銅;(丙) 莫耳的銅;(丙) 莫耳的水;(丁)6個水分子。依質量由大至小排列上述物質,何者正確?(原子量:Cu 莫耳的水;(丁)6個水分子。依質量由大至小排列上述物質,何者正確?(原子量:Cu 64) 64)
(A)丙>乙>丁 甲 (B)甲 甲 (B)甲 丁 丁 乙 乙 丙 (C)丁 丙 (C)丁 甲 甲 乙 乙 丙 (D)乙 丙 (D)乙 丙 丙 甲 甲 丁。 丁。
【答案】:(A)
【解析】:(甲)Cu原子量64,一個cu原子= ; ;
(乙) 莫耳的銅= 莫耳的銅= x64=64x10-21克 x64=64x10-21克
(丙) 莫耳的水=18x10-2克; 莫耳的水=18x10-2克;
(丁)6個水分子= 。 。
( )20.
下列有關原子量敘述何者錯誤?
(A)某元素原子量為X,則此元素一個原子的質量為Xamu (B)氧原子量為15.9994,故 原子質量小於15.9994 (C) 原子質量小於15.9994 (C) ,故碳原子量為12 (D)1個 ,故碳原子量為12 (D)1個 原子質量的1/12稱為1amu。【臺中一中】 原子質量的1/12稱為1amu。【臺中一中】
【答案】:(C)
【解析】:原子量為X,其質量數(質子數+中子數)約為X,因此1個核子=1amu,
(
)21. 根據國際純化學暨應用化學聯合會(IUPAC)於1961年訂定之原子量標準為
(A)以 為1.0000 (B)以 為1.0000 (B)以 為12.0000 (C)以 為12.0000 (C)以 為16.0000 (D)以自然界存在的氧原子為16.0000。 為16.0000 (D)以自然界存在的氧原子為16.0000。
【答案】:(B)
【解析】:IUPAC在1961年以C-12=12.0000,作為原子量的標準。
( )22.
下列何者所含的原子數目最多?(N 14、P 14、P 31、Cu 31、Cu 64) 64)
(A)31克之 (B)STP時11.2 L的 (B)STP時11.2 L的 (C)6.4克的Cu (D)STP時5.6 L的 (C)6.4克的Cu (D)STP時5.6 L的 。【師大附中】 。【師大附中】
【答案】:(D)
【解析】:(A)P4分子量=31x4=124,31克 莫耳數= 莫耳數= 的分子,有 的分子,有
(B)STP時1莫耳氣體的體積有22.4升,因此11.2 L的 = = , ,
有0.5x4=2莫耳原子。
(C)6.4克的Cu=
(D)STP時5.6 L的 = = ,有 ,有 x11= x11= 。 。
(
)23. 若原子量以碳 ( ( )為標準,其值由12改訂成24,則一個氧原子的質量最接近下列何者? )為標準,其值由12改訂成24,則一個氧原子的質量最接近下列何者?
(A) (B) (B) (C) (C) (D) (D) 克。 克。
【答案】:(B)
【解析】:碳的原子改變,所有原子的原子量跟隨改變,但是每個原子的實際質量並沒有改變。
所以若O的原子量為16時,表示6.02x1023個O原子有16克;
若O的原子量為32時,表示2x(6.02x1023)個O原子有32克;
因此每個O原子的質量= 。 。
( )24.
某金屬a克,完全溶解於鹽酸時,產生b莫耳的氫氣及 離子。下列何者為此金屬之原子量? 離子。下列何者為此金屬之原子量?
(A) (B) (B) (C) (C) (D) (D) (E) (E) 。【臺南女中】 。【臺南女中】
【答案】:(A)
【解析】:M+HClàH2+M3+ 有b莫耳的氫氣,便有2b莫耳的氫原子,因此有2b莫耳的Cl原子,形成M的氯化物時,化學式為MCl3,所以M的莫耳數有
M金屬有a克,假設原子量為M,則 M的原子量= M的原子量= 。 。
(
)25. 關於元素的同位素,何者正確?
(A)有相同質量數,但不同的質子數 (B)有相同電子數,但其質子數及質量數不同 (C)有不同的質量數,但有相同的質子數與電子數 (D)有不同的化學性質。
【答案】:(C)
【解析】:同位素是指相同的原子序,但不同的質量,或是,相同的質子數,但不同的中子數。
由於原子不帶電,因此質子數必定等於電子數,但是中子數卻不相同。
由於質子數相同,因此化學性質相同。
( )26.
下列哪些物質含有相同的原子數?
(甲)0.2莫耳的氧氣;(乙)  個水分子;(丙) 0.1莫耳的二氧化碳;(丁) 9.8克的硫酸(分子量: 個水分子;(丙) 0.1莫耳的二氧化碳;(丁) 9.8克的硫酸(分子量: );(戊) 0.05莫耳的過錳酸鉀( );(戊) 0.05莫耳的過錳酸鉀( ) )
(A)乙丙 (B)甲丙戊 (C)乙丙丁 (D)甲丙丁 (E)丙戊。【成功高中】
【答案】:(E)
【解析】:(甲)
0.2莫耳的氧氣(O2)=0.2x2=0.4莫耳O原子;
(乙)  個水分子(H2O)=3莫耳水分子=3莫耳原子; 個水分子(H2O)=3莫耳水分子=3莫耳原子;
(丙) 0.1莫耳的二氧化碳(CO2)=0.1x3=0.3莫耳原子;
(丁) 9.8克的硫酸(分子量: )=0.1莫耳硫酸分子=0.1x7=0.7莫耳原子; )=0.1莫耳硫酸分子=0.1x7=0.7莫耳原子;
(戊) 0.05莫耳的過錳酸鉀( )=0.05x6=0.3莫耳原子。 )=0.05x6=0.3莫耳原子。
(
)27. 鋁與200克的氧化鉻完全作用,可生成104克的鉻及204克的氧化鋁。若27克的鋁與氧完全作用,可生成若干克氧化鋁?
(A)43克 (B)51克 (C)76.5克 (D)102克。
【答案】:(B)
【解析】:鋁+氧化鉻→鉻+氧化鋁 X克+200克=104克+204克 ; X=108克。
鋁:氧化鋁=108:204=9:17=27:Y è Y=51克。
(
)28. A、B兩種元素化合成 、 、 、 、 三種化合物,今將三種化合物中A的質量固定,則B的質量依序所成的簡單整數比為何? 三種化合物,今將三種化合物中A的質量固定,則B的質量依序所成的簡單整數比為何?
(A)2:3:4 (B)1:4:6 (C)6:3:2 (D)6:3:4。
【答案】:(C)
【解析】:依倍比定律,A、B兩種元素化合成 、 、 、 、 三種化合物,將A通分成數目相同,則成為A6B24、A6B12、A6B8。 三種化合物,將A通分成數目相同,則成為A6B24、A6B12、A6B8。
因此A質量相同,所需B的質量比=24:12:8=6:3:2。
(
)29. 銅1.00克在空氣中加熱,可得氧化銅1.25克。另取銅2.00克溶於硝酸,加入氫氧化鈉生成氫氧化銅,再將氫氧化銅加熱便生成氧化銅,其重量為2.50克,此實驗可證明何種定律?
(A)質量守恆定律 (B)定比定律 (C)倍比定律 (D)亞佛加厥定律。
【答案】:(B)
【解析】:銅→氧化銅 銅:氧化銅=1.00:1.25=4:5;
銅2.00克溶於硝酸,加入氫氧化鈉生成氫氧化銅,再將氫氧化銅加熱便生成氧化銅,其重量為2.50克,此時的銅:氧化銅=2.00:2.5=4:5。
因此遵守定比定律(化合物的組成元素有一定的質量比)。
(
)30. 溴的原子序為35,已知溴存在兩種同位素,其百分率幾近相同,而溴的原子量為80,則溴的兩個同位素中的中子數分別為何?
(A)43和45 (B)79和81 (C)42和44 (D)44和46 (E)45和47。【94學測】
【答案】:(D)
【解析】:溴原子序為35,所以有35個質子,原子量為80,所以平均的中子數=80-35=45,
因此溴的同位素含量約相等時,中子數目應為44、46,或是43、47或42、48等,平均值才會是45。
(
)31. 鎂原子量是24,則哪一個數值不是一個鎂原子質量?
(A)24 amu (B) 克 (C) 克 (C) (D) (D) 克。 克。
【答案】:(C)
【解析】:1個核子(包含質子與中子)質量,稱為原子質量單位或1個amu,
1amu=1.67x10-27公斤=1.67x10-24公克。
鎂原子量24,有24個質子和中子,所以有 24 amu = 24 x (1.67x10-24) 公克,
(
)32. 關於原子,下列敘述何者錯誤?
(A)分子中所有原子數恆為整數 (B)不同元素之原子,其性質亦不同 (C)原子種類及數目相同,所形成的物質不一定相同 (D)同元素之原子,其質量必相同。
【答案】:(D)
【解析】:(A)原子是構成分子的最小單位,分子中的原子恆為整數。
(B)依道耳頓的原子說,不同元素的原子,性質必定不同。
(C)由於有同分異構物存在,即使原子種類及數目相同,由於排列方式不同,因此組成物質的性質也不相同。
(D)由於有同位素,因此同一原子的質量不一定會相同。
(
)33.  ,下列何種關係是2:1:2? ,下列何種關係是2:1:2?
(A)莫耳數比 (B)體積比 (C)質量比 (D)原子數比。
【答案】:(A)
【解析】:化學反應式的係數比=2:1:2,但僅反應物為氣體,而生成物則為液體,所以僅反應物遵守氣體反應體積定律,係數比=分子數比=莫耳數比。
僅反應物的體積比=2:1,而生成物為水H2O(L),則不遵守體積比。
( )34.
在下列物質中,其物質的量為0.2 mol的是
(A) (B) (B) (C) (C) (D) (D) 。【臺中二中】 。【臺中二中】
【答案】:(B)
【解析】:CO2的分子量=44,2.2克的CO2=
H2O的分子量=18,3.6克的H2O=
O2的分子量=32,3.2克的O2=
H2SO4的分子量=98,49克的H2SO4= 
(
)35. 鉛的兩種氧化物,經分析得知其中分別含鉛的重量百分率為92.83%和89.62%,則當其所含的氧重量相等時,所含之鉛重量比約為多少?
(A)3:2 (B)2:1 (C)1:2 (D)2:3。
【答案】:(A)
【解析】:當兩氧化物中含氧的質量相同,因此香江O的質量通分使其相等,再比較Pb的質量。
 
A氧化物與B氧化物中含鉛的質量比=(92.83x10.38):(89.62x7.17)=3:2
(
)36. 關於化合物 、NO、 、NO、 ,下列相關敘述何項錯誤? ,下列相關敘述何項錯誤?
(A) 與NO之間,有符合倍比定律的關係 (B)NO與 與NO之間,有符合倍比定律的關係 (B)NO與 之間,有符合倍比定律的關係 (C) 之間,有符合倍比定律的關係 (C) 與 與 之間,有符合倍比定律的關係 (D) 之間,有符合倍比定律的關係 (D) 與 與 之間,不符合倍比定律的關係。 之間,不符合倍比定律的關係。
【答案】:(D)
【解析】:倍比定律為:兩不同的元素組成多種化合物,若固定其中一元素的質量,則另一元素的質量成簡單的整數比。
N2O、NO、NO2皆為N和O所組成的不同化合物,所以三者皆遵守倍比定律。
( )37.
下列何者的質子數,中子數,電子數相等?
(A) (B) (B) (C) (C) (D) (D) 。【成功高中】 。【成功高中】
【答案】:(B)
【解析】: 有17個質子、18個中子,18個電子; 有17個質子、18個中子,18個電子; 有8個質子,8個中子,8個電子。 有8個質子,8個中子,8個電子。
 有11個質子,12個中子,10個電子; 有11個質子,12個中子,10個電子; 有10個質子,12個中子,10個電子。 有10個質子,12個中子,10個電子。
( )38.
某化合物含r個結晶水,該水合物3.2克加熱完全除去結晶水後,重量變為1.4克,則該水合物之式量為下列何者?
(A)14r (B)32r (C)50r (D)64r。【武陵高中】
【答案】:(B)
【解析】:化合物含r個結晶水,因此化合物的形式為X・rH2O,
假設化合物分子量為A,1個結晶水分子量=18,則r個結晶水的質量=r・18=18r;
結晶水的質量=3.2-1.4=1.8克;
 è
A=32r。 è
A=32r。
(
)39. 反應 ,已知分子量 ,已知分子量 , , ,欲生成100克R需N幾克? ,欲生成100克R需N幾克?
(A) (B) (B) (C) (C) (D) (D) 。【臺中一中】 。【臺中一中】
【答案】:(B)
【解析】:ax60+bx30=cxR è
R= 或cR=60a+30b 或cR=60a+30b
30b:cR=X:100 è
(
)40. 同溫同壓下,氣體甲2.0升重1.20克,氣體乙1.0升重0.64克。已知乙氣體為氧氣,而甲僅由氧和氮二元素結合組成,則下列何者為甲氣體的化學式?(N 14,O 14,O 16) 16)
(A) (B)NO (C) (B)NO (C) (D) (D) 。 。
【答案】:(B)
【解析】:氣體甲2.0升重1.20克,氣體乙1.0升重0.64克,因此乙氣體2升種0.64x2=1.28克。
同溫、同壓、同體積下,甲的分子數=乙的分子數;
甲氣體質量:乙氣體質量=1.20:1.28=X:32 X=30;
甲氣體的化學式為NO。
( )41.
某化合物由x 6.92克和碳0.584克所組成,設已知4個x原子能和1個碳原子結合,則x的原子量為
(A)18.1 (B)35.5 (C)53.5 (D)71.0。【高雄女中】
【答案】:(B)
【解析】:X質量:C質量=6.92:0.584=X:12 X=142.19=4個X原子質量
1個X原子質量142.19/4=35.55。
(
)42. 針對等數目的 原子與某未知原子進行質量測定,得知兩者的質量分別為18.0與36.0克,則下列何者可能為該未知原子的原子量? 原子與某未知原子進行質量測定,得知兩者的質量分別為18.0與36.0克,則下列何者可能為該未知原子的原子量?
(A)18 (B)24 (C)36 (D)48 (E)54。【92大考中心】
【答案】:(B)
【解析】:質量比=原子量比 è C:X=18.0:36.0=12:X X=24
( )43.
兩元素A和B反應,生成化合物P(質量:A占25%,B占75%)和Q(質量:A占40%,B占60%),若P的化學式為 ,則下列何者為Q的化學式? ,則下列何者為Q的化學式?
(A)AB (B) (C) (C) (D) (D) (E) (E) 。【松山高中】 。【松山高中】
【答案】:(A)
【解析】: è è 
當B的質量固定時,化合物P與Q中的含A的質量比為1:2,因此
化合物P與Q中含A的莫耳數比為1:2,因此P的化學式為AB2
Q的化學式為A2B2或是AB。
(
)44. 化合物 克中含5.6克的A。另一由A、B元素組成的化合物B之重量組成為22.2%,試問此化合物之化學式為 克中含5.6克的A。另一由A、B元素組成的化合物B之重量組成為22.2%,試問此化合物之化學式為
(A)AB (B) (C) (C) (D) (D) 。 。
【答案】:(A)
【解析】: è è

當兩化合物中,A的質量固定,則B的質量比=3:2;
因此A2B3中含有3個B元素,則化合物X中,有2個X元素
化合物X的化學式為A2B2或是AB。
(
)45. 化合物甲、乙、丙均由A、B兩元素組成,若A的質量相同時,B的質量比甲:乙:丙 1:2:3,若B的質量相同時,A的質量比甲:乙:丙 1:2:3,若B的質量相同時,A的質量比甲:乙:丙 ? ?
(A)3:2:1 (B)6:3:2 (C)2:3:6 (D)1:2:3。
【答案】:(B)
【解析】: è è 
重新通分,使甲、乙、丙化合物中的B元素皆相等,此時A元素的質量比=6:3:2。
(
)46. 下列何者具有最多量的氧分子?
(A)3.2克氧氣 (B)標準狀態下,2.24升的氧氣 (C) 個氧分子 (D)0.2莫耳的氧氣。(氧原子量 個氧分子 (D)0.2莫耳的氧氣。(氧原子量 16.0) 16.0)
【答案】:(D)
【解析】:(A)3.2克氧氣= 氧分子。 氧分子。
(B)標準狀態下,2.24升的氧氣= 的氧氣。 的氧氣。
(C) 個氧分子= 個氧分子= 的氧分子。 的氧分子。
(D)0.2莫耳的氧氣。 ç 量最多。
(
)47. 48克的鎂帶不完全燃燒後,產物含未燃燒的鎂共重70克,則有多少克的氧參與此燃燒反應?(原子量:O 16,Mg 16,Mg 24.0) 24.0)
(A)8 (B)11 (C)22 (D)32。
【答案】:(C)
【解析】:鎂+氧à氧化鎂 48克+X=70克 X=70-48=22克。
( )48.
氯有兩種同位素,分別是 及 及 ,已知平均原子量為35.50,則 ,已知平均原子量為35.50,則 及 及 兩者的存在含量比例約為多少? 兩者的存在含量比例約為多少?
(A)1:4 (B)4:1 (C)1:3 (D)3:1。【北一女中】
【答案】:(D)
【解析】:假設35Cl含佔X,及37Cl含量佔(1-x),則35X+37(1-x)=35.50
-2X=-1.5 X=0.75 35Cl佔0.75=75%; 37Cl含量佔1-0.75=0.25=25%
35Cl和37Cl的含量比=75:25=3:1。
( )49.
已知某金屬的一種氧化物含氧重25%,其另一種氧化物的含氧重為33%,則此金屬的原子量可能為何?
(A)24 (B)32 (C)64 (D)96 (E)128。【臺南女中】
【答案】:(D)
【解析】:
設金屬M離子的價數為m價及n價,則形成的氧化物化學式分別為 及 及
則 è è   è X=24m; è X=24m;
 è è   è X=16n; è X=16n;
因此原子量X應為16及24的公倍數,所以X應為48的倍數。
(
)50. 反應 ,當取8克A與10克B充分反應後,A被用完了但剩下2克的B,根據質量守恆定律,則A、B、C三者作用的質量比為何? ,當取8克A與10克B充分反應後,A被用完了但剩下2克的B,根據質量守恆定律,則A、B、C三者作用的質量比為何?
(A)8:10:2 (B)1:2:1 (C)1:1:2 (D)8:8:2。
【答案】:(C)
【解析】:依質量守恆定律,A消耗的質量+B消耗的質量=C產生的質量。
8克的A剩下2克的A,所以A消耗6克,
(
)51. 氮與氧兩元素可形成下列三種化合物NO、N2O3、N2O5,若各化合物中氮元素之質量相等時,則各化合物中氧元素的質量比(NO:N2O3:N2O5)為何?
(A)1:3:5 (B)2:3:5 (C)5:3:2 (D)15:10:6。(原子量:N 14,O 14,O 16) 16)
【答案】:(B)
【解析】:依倍比定律,NO、N2O3、N2O5,其中N的最小公倍數為2,將其擴分成N2O2、N2O3、N2O5,使其氮原子的質量相同,則氧原子的質量比會成為2:3:5。
(
)52. 下列關於物質的差異,何者錯誤?
(A)氧氣與氮氣性質不同是因原子之種類不同 (B)一氧化碳與二氧化碳之性質不同是因原子個數不同 (C)乙炔C2H2與苯C6H6之性質不同是因其原子種類及原子個數比不同 (D)甲醚與乙醇之分子式相同但性質不同,是因其原子排列不同。
【答案】:(C)
【解析】:(A)道耳頓的原子說認為,相同的原子性質相同,不同的性質不同。因此氧氣與氮氣性質不同,是因原子之種類不同。
(B)化合物所含的元素依一定的比例相結合,因此一氧化碳與二氧化碳為不同的化合物,兩者的性質不同。
(C)乙炔C2H2與苯C6H6之性質不同,是因所含的原子種類及原子個數不同,但是兩者的個數比相同。
(D)甲醚CH3OCH3與乙醇C2H5OH之分子式相同但性質不同,是因其原子排列不同,稱為同分異構物。
(
)53. 下列物質的敘述,何者正確?
(A) 與 與 (臭氧)由相同原子組成,故為同位素 (B)市售雙氧水受熱分解出 (臭氧)由相同原子組成,故為同位素 (B)市售雙氧水受熱分解出 ,故雙氧水是純物質 (C)金剛石與石墨是同素異形體 (D)氫與氧只能形成一種化合物。 ,故雙氧水是純物質 (C)金剛石與石墨是同素異形體 (D)氫與氧只能形成一種化合物。
【答案】:(C)
【解析】:(A) 與 與 (臭氧)由相同原子組成,故為同素異形體。 (臭氧)由相同原子組成,故為同素異形體。
(B)市售雙氧水為過氧化氫的水溶液,受熱能分解出 ,雙氧水是混合物。 ,雙氧水是混合物。
(C)金剛石與石墨成分皆為碳,但是金剛石為四面體結構,石墨為平面結構,兩者是同素異形體。
(D)氫與氧能形成不同的化合物,例如水H2O及過氧化氫H2O2。
(
)54. 下列敘述何者可說明定比定律?
(A)甲醚與乙醇分子式相同 (B)硫有斜方硫、單斜硫、彈性硫等三種同素異形體 (C)硫之氧化物有 及 及 (D)CuO可由銅燃燒而得,亦可由碳酸銅加熱分解而得。 (D)CuO可由銅燃燒而得,亦可由碳酸銅加熱分解而得。
【答案】:(D)
【解析】:化合物無論製造方法為何,所含成分元素的質量比有一定的比值。
銅+氧à氧化銅 碳酸銅à氧化銅+二氧化碳
無論何種方法製造氧化銅,其中銅和氧的質量比皆相同。
(
)55. 同溫、同壓下,2公升的氮與4公升的甲烷( )所含的分子數比為下列何項? )所含的分子數比為下列何項?
(A)1:2 (B)1:5 (C)2:1 (D)2:5。
【答案】:(A)
【解析】:同溫同壓下,氣體的體積比=分子數比。
因此體積比=2升:4升=1:2 è 莫耳數比=分子數比=1:2。
(
)56.  仿效拉瓦節所做的汞鍛燒實驗如圖,下列敘述,何者正確? 仿效拉瓦節所做的汞鍛燒實驗如圖,下列敘述,何者正確?
(A)汞加熱後的產物重量比汞小 (B)汞加熱後產生灰色的氧化汞 (C)利用本實驗可以證明空氣是混合物 (D)右側玻璃鐘罩內的水位變化是由於汞蒸發所導致。
【答案】:(C)
【解析】:如圖,汞加熱會消耗氧氣,使右側玻璃罩內的氧氣減少,壓力減少,因此玻璃罩內的液面會上升。反應為:汞+氧à氧化汞(紅色粉末)。因此左側曲頸瓶內的質量會增加。
玻璃罩內的空氣體積減少約1/5,表示內含氧氣約1/5的體積,可以說明空氣是混合物。
( )57.
小明在實驗室中進行下列兩個實驗:
實驗一:取鎂0.6克在0.4克的氧氣中燃燒,可得氧化鎂1.0克。
實驗二:另取鎂1.2克在3克二氧化碳中燃燒,則應可生成碳0.3克及氧化鎂多少克?
(A)3.6克由質量守恆定律求出 (B)2.0克由定比定律求出 (C)1.2克由質量守恆定律求出 (D)0.4克由定比定律求出。【中山女中】
【答案】:(B)
【解析】:鎂+氧à氧化鎂 0.6克+0.4克=1.0克
因此鎂:氧化鎂=0.6:1.0=3:5(定比定律)
鎂+二氧化碳à碳+氧化鎂 1.2克:X=3:5 X=2.0克
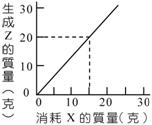
(
)58. 有一反應,由X與Y化合生成Z。其反應如下: (a、b、c分別代表係數)。而反應物X與產物Z的質量關係如右圖。試問當有8克的Z生成時,需要多少克的Y? (a、b、c分別代表係數)。而反應物X與產物Z的質量關係如右圖。試問當有8克的Z生成時,需要多少克的Y?
(A)1 (B)2 (C)3 (D)5。
【答案】:(B)
【解析】:利用質量守恆定律:消耗X的質量+消耗Y的質量=產生Z的質量。
如圖,消耗15克X,生成20克Z,所以需要5克Y。
因此Z:Y=20克:5克=4:1=8克:Y
Y=2克。
(
)59. 常溫、常壓下,二氧化碳(CO2)與氨(NH3)兩氣體體積相同,則以下何者錯誤?(以下均為CO2:NH3;原子量:C 12,H 12,H 1,O 1,O 16,N 16,N 14) 14)
(A)分子數比1:1 (B)原子數比3:4 (C)重量比44:17 (D)密度比1:1。
【答案】:(D)
【解析】:利用亞佛加厥定律:同溫、同壓、同體積的任何氣體,有相同的分子數。
常溫常壓下,CO2和NH3有相同的體積,因此兩氣體有相同的分子數目。
分子數比=1:1;因此原子數比CO2:NH3=3:4;
分子數比=莫耳數比=1:1,所以重量比=質量比CO2:NH3=44:17
密度=質量/體積CO2:NH3=44/1:17/1=44:17
(
)60. 在0 、1 atm下,某氣體0.625克占0.5升的氣體,此氣體是 、1 atm下,某氣體0.625克占0.5升的氣體,此氣體是
(A) (B) (B) (C) (C) (D) (D) 。 。
【答案】:(A)
【解析】:標準狀況下(STP),是指0℃、1 atm下,此時的任何氣體,體積皆為22.4升。
 X=28克,所以某氣體為N2。 X=28克,所以某氣體為N2。
|















