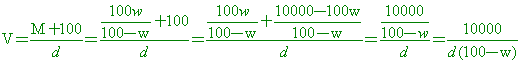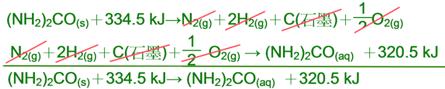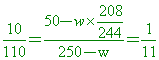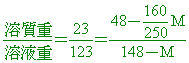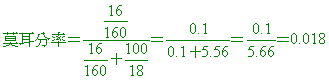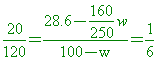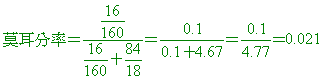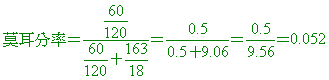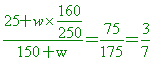|
( )1.
取 80%的濃鹽酸(比重為 1.6)100 mL 及 40%的濃鹽酸(比重為 1.4)200mL,再加水調配成 20%的稀鹽酸(比重為 1.2),則原兩鹽酸與所加入水的體積之和與後來調配成的稀鹽酸之體積相差多少 mL?
(A) 30 (B) 60 (C) 90 (D) 120。
【答案】: (B)
【解析】:濃鹽酸質量=VxD=100x1.6=160克 溶質質量=160x0.8=128克
濃鹽酸質量=200x1.4=280克
溶質質量=280x0.4=112克
兩溶液混合再加水X克稀釋,則20%=0.2=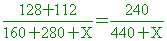
88+0.2X=240 0.2X=152 X=760克
混合後溶液總質量=160+280+760=1200克 溶液總體積=1200/1.2=1000cm3
混合前後體積變化=(100+200+760)-1000=1060-1000=60cm3
( )2.
在 100 毫升純水(設比重為 1)中通入 NH3(g),直到溶液之比重為 d、含氨的重量百分率濃度為 W% 時,則此時氨水溶液之體積為若干毫升?
(A) 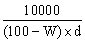 (B) (B)  (C) (C) 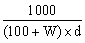 (D) (D) 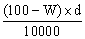 。 。
【答案】: (A)
【解析】:假設加入氨氣的質量M克,則溶液的重量為M+100x1=M+100
溶液的體積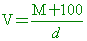 , 氨的重量百分率濃度 W%= , 氨的重量百分率濃度 W%=
交叉相乘,得到 100M=wM+100w 100M-wM=100w M(100-w)=100w
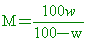 因此溶液體積 因此溶液體積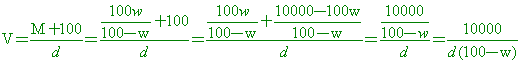
( )3.
欲用硫酸銅晶體(CuSO4.5H2O,式量=250)配製 1.00 M 硫酸銅溶液,下列各項敘述何者正確?
(A)稱取 250 克硫酸銅晶體溶於 1.000 升水中 (B)稱取 125 克硫酸銅晶體溶於 875 克水中 (C)先用適量水使 125 克硫酸銅晶體溶解後,在容量瓶中加水至溶液恰成為 1.000 升 (D)先用適量水使 250 克硫酸銅晶體溶解後,在容量瓶中加水至溶液恰成為 1.000 升。
【答案】: (D)
【解析】:配製 1.00 M 硫酸銅溶液1公升,需要的溶質=MxL=1x1=1莫耳CuSO4
CuSO4.5H2O的分子量=250,因此需要250克的硫酸銅晶體
先取適量的水,將250克的硫酸銅晶體先溶解,在容量瓶中加水至溶液恰成為 1.000 升。
( )4.
已知 N2(g)+2H2(g)+C(石墨)+ O2(g) →
(NH2)2CO(s)
=-334.5 kJ
N2(g)+2H2(g)+C(石墨)+ O2(g) →
(NH2)2CO(aq)
ΔH=-320.5 kJ
則有關尿素在水中溶解之敘述,何者正確?
(A)尿素在水中溶解為放熱反應,故溫度升高,溶解度增大 (B)尿素在水中溶解為吸熱反應,故溫度升高,溶解度增大 (C)尿素在水中溶解為放熱反應,故溫度升高,溶解度減小 (D)尿素在水中溶解為吸熱反應,故溫度升高,溶解度減小。
【答案】: (B)
【解析】:<0,代表放熱反應;原方程式可表示成
N2(g)+2H2(g)+C(石墨)+O2(g) → (NH2)2CO(s)+334.5 kJ……(1)
N2(g)+2H2(g)+C(石墨)+ O2(g) → (NH2)2CO(aq) +320.5 kJ……(2)
將(1)式相反,得到 (NH2)2CO(s)+334.5 kJ→N2(g)+2H2(g)+C(石墨)+O2(g)
再與(2)式合併,可得到
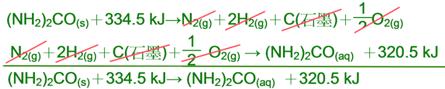
334.5-320.5=14KJ
於是 (NH2)2CO(s)+14 kJ→ (NH2)2CO(aq) 表示固體尿素(NH2)2CO(s)變成溶液的(NH2)2CO(aq),
這是溶解的反應,可知:尿素(NH2)2CO溶解時為吸熱反應,溶解後溶液的溫度會降低,
依可逆反應的平衡原理:
提高溫度,反應容易向右進行,可使溶解度增加;
溫度若降低(移除熱量),會導致逆向反應,使溶解度會減小。
因此要增加溶解度,最好的方法是提高溫度,當溫度升高時(加入熱量),可促使正向反應的進行,能增加尿素的溶解度。
( )5.
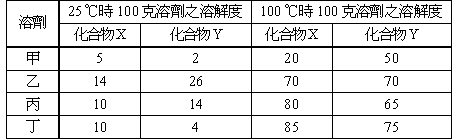
化合物 X 及 Y 在不同溫度時,對於甲、乙、丙和丁四種不同溶劑之溶解度如下表所示。設有一試樣含有 60 克 X 及 10 克 Y。如果要從試樣中回收最大量的純物質 X,應使用何種溶劑來做再結晶?
(A)甲 (B)乙 (C)丙 (D)丁。
【答案】: (D)
【解析】:(A)取甲溶液X克,100℃時100克甲溶解X化合物20克,因此100:20=X:60 è X=300克
25℃時100克甲可溶解X化合物 5克,因此100:5=300:Y èY=15克
所以100℃時,60克的X完全溶解,降至25℃時只溶解15克,因此60-15=45克沉澱
(B)取乙溶液X克,100℃時100克甲溶解X化合物70克,因此100:70=X:60 è X=86克
25℃時100克乙可溶解X化合物 14克,因此100:14=86:Y èY=12克
所以100℃時,60克的X完全溶解,降至25℃時只溶解12克,因此60-12=48克沉澱
(C)取丙溶液X克,100℃時100克丙溶解X化合物80克,因此100:80=X:60 è X=75克
25℃時100克丙可溶解X化合物 10克,因此100:10=75:Y èY=7.5克
所以100℃時,60克的X完全溶解,降至25℃時只溶解7.5克,因此60-7.5=52.5克沉澱
(D)取丁溶液X克,100℃時100克丁溶解X化合物85克,因此100:85=X:60 è X=70.6克
25℃時100克丁可溶解X化合物 10克,因此100:10=70.6:Y èY=7.06克
所以100℃時,60克的X完全溶解,降至25℃時只溶解7.5克,因此60-7.06=52.94克沉澱
( )6.
 定溫、定壓下,溶液的最大濃度稱為飽和溶解度,簡稱溶解度。下圖為某一鹽類 MX(s)
的溶解度與溫度關係曲線圖;若在 20 ℃時做實驗,想要完全溶解 45 g 的 ,則至少需加入 20 ℃的水若干 g? 定溫、定壓下,溶液的最大濃度稱為飽和溶解度,簡稱溶解度。下圖為某一鹽類 MX(s)
的溶解度與溫度關係曲線圖;若在 20 ℃時做實驗,想要完全溶解 45 g 的 ,則至少需加入 20 ℃的水若干 g?
(A) 50 (B) 100 (C) 150 (D) 200。
【答案】: (C)
【解析】:依圖形,20℃時,100克水最多溶解30克MX,則:
100:30=X:45 X=150克水
( )7.
20 ℃下,甲、乙兩杯分別盛有 200 克及 300 克飽和硝酸鉀溶液,兩杯要析出等質量晶體的條件是
(A)同時降溫至 10 ℃ (B)甲、乙兩杯各蒸去 20 克的水 (C)甲杯蒸去 20 克水,乙杯蒸去 30 克水 (D)甲杯降溫至 10 ℃,乙杯降溫至 6 ℃。
【答案】: (B)
【解析】:固定的水量能溶解等量的溶質,相反地,若蒸發的水量星同,則能析出的晶體量也相等。
因此要析出等量的固體,不論溶液質量若干,不論大杯或小杯,只要蒸發的水量相等即可。
( )8.
下列哪一條件可以增加氣體在液體中的溶解度?(假設兩者之間無化學反應發生)
(A)高溫、高壓 (B)低溫、高壓 (C)高溫、低壓 (D)低溫、低壓。
【答案】: (B)
【解析】:氣體的溶解度需要低溫高壓,在溫度降低或是壓力增加時,氣體的溶解度才會大,才能溶解更多的氣體。
( )9.
( )10. 若化學實驗室中有一瓶標示重量百分率為30 %的NaOH溶液,則表示:
(A)每升NaOH溶液中含有30毫升的NaOH (B)每100克的NaOH溶液中含有30克的NaOH (C)每100毫升的NaOH溶液中含有30毫升的NaOH (D)每100克的NaOH溶液中含有30克的水。
【答案】: (B)
【解析】:30 %的NaOH溶液,表示每100克的NaOH溶液中含有30克的NaOH溶質。
( )11. 若要配製0.1 M的葡萄糖(C6H12O6)水溶液1升,則下列何者是正確的操作方法?
(A)將18克的葡萄糖加入1升的水中攪拌均勻 (B)將18克的葡萄糖加微量的水,攪拌使其溶解後,再加水使其總體積達1升 (C)將1升的水加入0.1克的葡萄糖,攪拌均勻 (D)將0.1莫耳的水加入葡萄糖,使其總體積達1升。(分子量:C6H12O6=180)
【答案】: (B)
【解析】:0.1M的葡萄糖(C6H12O6)水溶液1升,含溶質(葡萄糖)0.1x1=0.1莫耳,
葡萄糖的分子量=180,因此1升的溶液中含溶質質量=0.1x180=18克葡萄糖
因此配置溶液之前,先求得需要溶質的質量,
將18克的葡萄糖先加入適量的水,攪拌使葡糖糖能完全溶解後,再加水使其總體積達1升。
( )12. 下列敘述何者正確?
(A)溶液保留有溶質的本性 (B)溶液有一定的熔點,但無一定的沸點 (C)四氯化碳可與水形成一溶液 (D)金屬可與金屬形成溶液,但金屬與非金屬不可形成溶液。
【答案】: (A)
【解析】:(A)溶液為均勻混合物,其中的每一物質僅是相混合,不產生化學變化,因此能保留原有溶質的本性。
(B)溶液為數種物質混合,沒有一定的熔點,也無一定的沸點。
(C)四氯化碳難溶於水,無法與水形成均勻的溶液。
(D)金屬可與金屬形成溶液,金屬與非金屬也可形成溶液,只要能均勻混合成為單向的均質混合物,皆可成為溶液。
( )13. 某一汙水中若含有0.0603 ppm的Hg,則表示其體積莫耳濃度為多少M?(原子量:Hg=201)
(A) 3×10-7 (B) 2.8×10-6 (C) 3×10-6 (D) 3×10-4。
【答案】: (A)
【解析】:0.0603 ppm表示1公噸的廢水有0.0603克的溶質Hg,因此
溶質莫耳數=0.0603/201=3x10-4莫耳
1公噸的溶液=1000公斤的溶液 溶液體積有1000公升
莫耳濃度CM=(3x10-4)/1000=3x10-7M
( )14. 有關溶液的敘述,下列何者錯誤?
(A)溶液是由純物質所構成的均勻化合物 (B)溶液的組成可以改變 (C)溶液有固態、液態、氣態等三類 (D)溶液不一定都可導電。
【答案】: (A)
【解析】:(A)溶液是由多種純物質所混合而成的均勻混合物,所含的各種溶質間沒有進行化學變化,因此組成物質的原有性質並不改變。
(B)溶液的組成可以依任意比例調整,因此沒有固定的溶質比例。
(C)溶液依狀態分別,可以為固態、液態、氣態等三大類。
(D)溶液不一定都可導電,糖能溶於水,但不導電,酒精溶於水,但也不能導電,為非電解質。
( )15. 取某醣類的60 ℃飽和溶液200克,冷卻至20 ℃時析出晶體15克,已知此醣類在60 ℃時的溶解度為60克/100克水,則20 ℃時溶解度為:
(A) 37.5克/100克水
(B) 45.0克/100克水
(C) 48.0克/100克水
(D) 52.5克/100克水。
【答案】: (C)
【解析】:醣類在60 ℃時的溶解度為60克/100克水,形成溶液160克;
因此飽和溶液200克中含溶質質量X 60:160=X:200 è X=75克
200克溶液中含溶質75克,因此含水200-75=125克
冷卻至20 ℃時析出晶體15克,因此溶解了75-15=60克
即 125克的水中溶解了60克的溶質固體,因此溶解度為125:60=100:Y
Y=48克,相當於在20 ℃時,100克水能溶解48克的溶質
溶解度表示成48克/100克水
( )16. 某人配製食鹽水溶液,將200克食鹽水置入500克、20 的水中。完全攪拌後,發現溶液底部沉有過量食鹽晶體。此溶液是: 的水中。完全攪拌後,發現溶液底部沉有過量食鹽晶體。此溶液是:
(A)過飽和溶液 (B)飽和溶液 (C)未飽和溶液 (D)理想溶液。
【答案】: (B)
【解析】:當物質發生沉澱,即表示溶質的溶解已達到飽和極限,因此為飽和溶液。
( )17. 下列何者是溶液?
(A)鹽酸 (B)過氧化氫 (C)乙醇 (D)葡萄糖。
【答案】: (A)
【解析】:鹽酸是氯化氫的水溶液,過氧化氫的水溶液才是雙氧水;
乙醇的水溶液才成為各種酒類
葡萄糖溶於水才能成為溶液。
( )18. 體積莫耳濃度4.2 M,密度為1.188克/毫升的氫氧化鉀溶液,其重量百分率濃度為多少?
(A) 30 % (B) 25 % (C) 20 % (D) 15 %。(原子量:K=39)
【答案】: (C)
【解析】:氫氧化鉀KOH的分子量=39+1+16=56
假設溶液的體積為1公升(1000cm3)則
溶液的質量=VxD=1000x1.188=1188克
溶質質量=(4.2x1)x56=235.2克
重量百分率濃度=235.2/(1188)=0.198=19.8%,約為20%
( )19. 要配製0.100 M的標準溶液100毫升,最好要使用100毫升的下列哪一種儀器?
(A)燒杯 (B)量筒 (C)燒瓶 (D)容量瓶 (E)錐形瓶。
【答案】: (D)
【解析】:配置溶液不能在量筒,兩桶只能量體積,不能進行溶液配置。
燒杯、燒瓶、錐形瓶的瓶口太大,不適合精確地量液體體積;
僅容量瓶上端的瓶頸細長,靈敏度較高,有精確的刻度,能準確地量得液體的體積。
( )20. 在15 將水85毫升與乙醇15毫升互相混合,則所得乙醇溶液中,乙醇的體積莫耳濃度為若干?(在15 將水85毫升與乙醇15毫升互相混合,則所得乙醇溶液中,乙醇的體積莫耳濃度為若干?(在15 時各液體比重如下:水= 0.999,乙醇= 0.795,溶液= 0.987) 時各液體比重如下:水= 0.999,乙醇= 0.795,溶液= 0.987)
(A)2.59 M (B)3.05 M (C)2.64 M (D)2.75 M。
【答案】: (C)
【解析】:水85毫升與乙醇15毫升混合前的總體積為85+15=100毫升;
但是混合液的體積可能改變,混合一的質量可以加成(一定不變),因此
混合前的總質量為85x1+15x0.795=85+11.925=96.925克=混合液的總質量
混合液的總體積=M/D=96.925/0.987=98.2cm3
溶質(乙醇)莫耳數=11.925/46=0.26莫耳
體積莫耳濃度=0.26/0.0982=2.64M
( )21. 欲使400克的15% NaOH溶液其濃度變10%,需加4% NaOH溶液若干克?
(A)1000克 (B)500克 (C)333克 (D)267克(Na
= 23)。
【答案】: (C)
【解析】:400克的15% NaOH溶液和4% NaOH溶液X克,混合成10%,
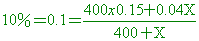 40+0.1X=60+0.04X 40+0.1X=60+0.04X
0.06X=20 X=333克
( )22. 下列何者為酒精濃度表示法?
(A)體積莫耳濃度 (B)重量莫耳濃度 (C)重量百分濃度 (D)體積百分濃度。
【答案】: (D)
【解析】:酒精為液態容質,一般常以體積百分率濃度來表示。
( )23. 取一體積為V毫升的燒杯,裝滿濃度為a M的某水溶液,此溶液倒去1/2,加水到滿,又倒去2/3,再加水到滿,又倒去3/4,最後此溶液的濃度為多少M?
(A)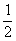 a (B) a (B)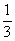 a (C) a (C)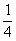 a (D) a (D) a。 a。
【答案】: (D)
【解析】:第一次倒掉1/2再加滿,剩餘溶質的莫耳數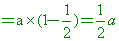
第二次倒掉2/3再加滿,剩餘溶質的莫耳數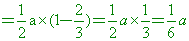
第三次倒掉3/4但未再加水,因此濃度不變,仍是
可直接寫成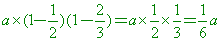
( )24. 若服用40 %的甲醇15 c.c.可能致死,試問該致死量相當於多少毫升的甲醇?
(A) 40 mL
(B) 10 mL (C) 6 mL (D) 4 mL。
【答案】: (C)
【解析】:甲醇和乙醇為液體,一般常以體積百分率濃度表示
甲醇(溶質)體積=15x0.4=6mL
( )25. 假設分子量為60的氣態物質配成了下列水溶液,問何者濃度最大?
(A)比重為1.02重量百分率濃度為6% (B)6.0克的溶質配成比重1.06的100毫升水溶液 (C)6.0克的溶質溶於100克的水
(D)25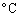 、1atm下2.45升溶於90克水。 、1atm下2.45升溶於90克水。
【答案】: (D)
【解析】:將四者都化成重量百分率濃度:
(A)比重為1.02,重量百分率濃度為6%
(B)溶液重量=100x1.06=106克,百分率濃度=6/106=0.057=5.7%
(C)重量百分率濃度=6/106=0.057=5.7%
(D)25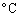 、1atm(NTP)下,1莫耳的氣體體積為24.5升, 、1atm(NTP)下,1莫耳的氣體體積為24.5升,
2.45升/24.5=0.1莫耳,0.1x60=6克溶質,
重量百分率濃度=6/(90+6)=6/96=0.0625=6.25%
因此(D)的重量百分率濃度最大。
( )26. 將631毫升甲醇(密度為0.792克/毫升)和501毫升水混合,所得溶液中甲醇濃度經測定為14.29莫耳/升。問甲醇與水混合前和混合後的總體積相差多少毫升?(甲醇的分子量:32)
(A)0 (B)39 (C)124 (D)132。
【答案】: (B)
【解析】:混合前總體積=631+501=1132mL
甲醇的莫耳數=質量/分子量=499/32=15.6莫耳
14.29M=15.6/V V=1.092公升=1092mL
混合前後體積相差=1132-1092=40mL
( )27. 在某溫度範圍內,溶液沒有產生相變化,則下列四種濃度表示法中,何者會受溫度的影響?
(A)重量百分率濃度 (B)莫耳濃度(體積莫耳濃度) (C)百萬分點 (D)莫耳分率。
【答案】: (B)
【解析】:溫度的改變僅影響體積的帳縮,不影響質量。
因此百分率濃度=溶質重/溶液重,和體積無關,和溫度無灣。
莫耳濃度=莫耳/升,溫度會改變體積,因此莫耳濃度會受體積變化影響。
百分點濃度是1公噸的溶液中含溶質質量(公克),因此溫度變化,不會影響百萬分點濃度。
莫耳分率是溶質莫耳數/溶液的總莫耳數,和體積無關。
( )28. 今欲配製32%的CuSO4水溶液100克,若以CuSO4•xH2O代替CuSO4時,需CuSO4•xH2O
50克,則x =?(原子量:Cu = 64,S = 32)
(A)5 (B)4 (C)3 (D)2。
【答案】: (A)
【解析】:配製32%的CuSO4水溶液100克需要溶質固體100x0.32=32克
CuSO4•xH2O=(64+32+16x4)+X(12+16)=160+18X
因此硫酸銅=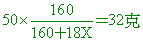 160+18X=250 X=5 160+18X=250 X=5
( )29. 將92%的乙醇100克溶於46克的純水中,所成溶液的莫耳分率為:
(A)0.40 (B)0.70 (C)0.80 (D)0.90。
【答案】: (A)
【解析】:乙醇質量=100x0.92=92克 乙醇莫耳數=92/46=2莫耳
水總質量=46+(100-92)=46+8=54克 水莫耳數=54/18=3莫耳
莫耳分率=2/(2+3)=2/5=0.4
( )30. 在化合物A的水溶液中,A的莫耳分率為水的莫耳分率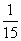 ,設A的分子量為270,水溶液的比重為1.40,則A的體積莫耳濃度(M)為若干? ,設A的分子量為270,水溶液的比重為1.40,則A的體積莫耳濃度(M)為若干?
(A)3.0 (B)2.8 (C)2.6 (D)2.4。
【答案】: (C)
【解析】:A的莫耳分率X,水莫耳分率Y,則 X+Y=1 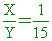 è Y=15X è Y=15X
X+15X=1 A的莫耳數= 水的莫耳數= 水的莫耳數=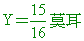
A的質量=270x(1/16)=16.875克 水的質量=18x(15/16)=16.875克
溶液總質量=16.875+16.875=33.75
溶液體積=33.75/1.40=24.1cm3=0.0241L
莫耳濃度=莫耳數/升=(1/16)/0.0241=2.59M
( )31. 以92.0%的硫酸配製成3.00 M的硫酸(比重1.18)1.00升時,需加入多少毫升的蒸餾水?(S = 32.0)
(A)780毫升 (B)860毫升 (C)920毫升 (D)908毫升。
【答案】: (B)
【解析】:溶液質量=1000mLx1.18=1180克 硫酸莫耳數=3.00Mx1.00L=3 (mol)
硫酸H2SO4=1x2+32+16x4=98
溶液中含硫酸質量=3x98=294克,
最初配置92%溶液X克,則0.92X=294 X=320克
需再加水=1180-320=860克,體積為860mL
( )32. 將20.0克乙醇溶於60.0克四氯化碳中,此溶液比重為1.28克/毫升(純CCl4之比重為1.51克/毫升),則此乙醇溶液的體積莫耳濃度為:
(A)7.25 (B)5.27 (C)6.96 (D)2.5 M。
【答案】: (C)
【解析】:乙醇為C2H5OH,分子量=46; 乙醇莫耳數=20/46=0.435(mol)
20.0克乙醇溶於60.0克四氯化碳中,溶液質量共80.0克
溶液體積=M/D=80/1.28 = 62.5 cm3 =0.0625L
莫耳濃度CM= 0.435/0.0625 = 6.96M
( )33. 下列有關飽和溶液的敘述,何者錯誤?
(A)飽和溶液中所溶解的溶質已達最大量 (B)飽和溶液中溶解和結晶仍繼續進行,是一種動平衡 (C)過飽和溶液中加入少許的晶種,則溶質全部析出 (D)定溫下,一物質的飽和溶液其重量百分率濃度為定值。
【答案】: (C)
【解析】:(A)正確,飽和溶液為溶液中所能溶解溶質的最大量,因此無法再溶解更多的溶質。
(B)正確,飽和溶液中溶解(正向反應)與沉澱(逆向反應)仍在進行,是一種動態平衡。
(C)錯誤,過飽和溶液中加入少許晶種,則溶質會沉澱製飽和為止,不會全部析出。
(D)正確,溫度一定時,物質的溶解度固定,所能容納的飽和溶液濃度為定植,
因此飽和溶液的重量百分率濃度亦為定值。
( )34. 用草酸晶體(H2C2O4•2H2O,分子量 = 126)配製1M的草酸溶液,下列何種方法最精確?
(A)使此晶體126克溶於1升水中 (B)取此晶體126克溶在874克水中 (C)先用適量水使此晶體126克溶解後,再加水至1升 (D)將此晶體溶於適量水中,恰成為飽和溶液。
【答案】: (C)
【解析】:1M的草酸溶液配製成1公升時,草酸莫耳數=MxL=1x1=1莫耳
草酸質量=1x126=126克,
先取適量的水將126克H2C2O4晶體先完全溶解後,再加水至1升
( )35. 比重1.16,21.0%的HCl水溶液150毫升和6.00M的HCl水溶液350毫升混合,假設體積有加成性,則混合後的鹽酸液濃度為多少M?(原子量:H = 1.0,Cl=35.5)
(A)5.2 (B)5.7 (C)6.2 (D)6.7。
【答案】: (C)
【解析】:比重1.16,21.0%HCl溶液150毫升,溶液質量=174克,
溶質質量=36.54克,容質莫耳數=36.54/36.5=1莫耳
6.00M的HCl水溶液350毫升, 溶質莫耳數=6x0.35=2.1莫耳
總莫耳數=1+2.1=3.1莫耳, 溶液體積=150+350=500mL=0.5L
體積莫耳濃度CM=3.1/0.5=6.2M
( )36. 將濃度2 M溶液一瓶,倒去半瓶再用水加滿,拌勻後再倒去 瓶,然後再以3 M溶液加滿,則溶液最後濃度為若干M?(設體積具加成性) 瓶,然後再以3 M溶液加滿,則溶液最後濃度為若干M?(設體積具加成性)
(A) 2 (B) 1.5 (C) 1.75 (D) 2.5
【答案】: (D)
【解析】:2 M溶液一瓶,倒去半瓶再用水加滿,則濃度成為2x(1-1/2)=1M
再倒去 瓶,剩下1/4瓶,濃度則保持不變,仍為1M,莫耳數成為 瓶,剩下1/4瓶,濃度則保持不變,仍為1M,莫耳數成為
1x1/4=0.25 mol
( )37. 欲由98%硫酸溶液(比重1.84)配製成34%硫酸溶液(比重1.255)1升時,需加蒸餾水約多少毫升?
(A)347 (B)653 (C)763 (D)819。
【答案】: (D)
【解析】:1升(1000cm3)的溶液質量=VxD=1000x1.255=1255克
溶質質量=1255x0.34=426.7克
由98%的硫酸溶液VmL,含溶質質量=Vx1.84x0.98=426.7 è V=236.6cm3
需加水質量=1255-236.6x1.84=819.6克 è加水819.6cm3
( )38. 下列關於溶液濃度的敘述,何者正確?
(A)任何溶液,其體積莫耳濃度與其重量莫耳濃度近似 (B)溶液重量莫耳濃度與該溶液重量的乘積即為該溶液中溶質的莫耳數 (C)酸類的濃度與其單位體積的乘積,表示其中所含有的氫離子莫耳數 (D)同溶劑的兩種溶液,若其莫耳分率相等,則二者的體積莫耳濃度也一致 (E)重量濃度不隨溫度改變而變化。
【答案】: (E)
【解析】:(A) 重量莫耳濃度是指每公斤的溶劑中,含溶質的莫耳數,即:
重量莫耳濃度 =溶質莫耳數 /溶劑重量(仟克)
只有稀薄溶液中,溶劑(水)的密度接近於1,溶液的體積(公升)=溶液的質量(公斤)
(B) 重量莫耳濃度Cm= è 溶質莫耳數=重量莫耳濃度x溶劑重量 è 溶質莫耳數=重量莫耳濃度x溶劑重量
(C)有強酸,有弱酸,酸的濃度不一定等於氫離子濃度,因此濃度與體積的乘積不一定是氫離子濃度的乘積。
(D) 莫耳分率=溶質的莫耳數/溶液的莫耳數
莫耳濃度=溶質莫耳數/溶液升數
兩者無關,溶液的莫耳數相等時,溶液的體積不一定會相等
(E)重量莫耳濃度=溶質莫耳數/溶劑的重量
和體積無關,因此和溫度無關,
重量莫耳濃度不會隨溫度改變。
( )39. 若警方查獲的某假酒含有甲醇5000ppm(1ppm相當於重量比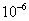 ),則該假酒每0.6公升(相當於一瓶)含有甲醇多少毫升?(甲醇和乙醇的密度都是0.78克/毫升) ),則該假酒每0.6公升(相當於一瓶)含有甲醇多少毫升?(甲醇和乙醇的密度都是0.78克/毫升)
(A)1 (B)3 (C)5 (D)6。
【答案】: (B)
【解析】: 每1公噸溶液中,含溶質的克數,或每1公升(公斤)溶液中,含溶質的毫克數(mg)
 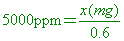
含溶質(甲醇)=5000x0.6=3000mg=3克
( )40. 配製0.50M氫氧化鈉水溶液的下列各方法中,何者最佳?(原子量:Na=23,O=16,H=1.0)
(A)用電子天平稱2.00克氫氧化鈉置於100毫升燒杯中,加水使溶,再使水面與100毫升的刻度齊高 (B)用三臂天平稱2.00克氫氧化鈉置於100毫升容量瓶中,加水使溶解,再使水面與瓶頸的刻度齊高 (C)用三臂天平稱1.00克氫氧化鈉置於50毫升錐形瓶中,加水使溶,再使水面與50毫升的刻度齊高 (D)用1升燒杯中將1.00M之氫氧化鈉注入至刻度500毫升處,再加水至1升之刻度處。
【答案】: (B)
【解析】:題目未要求溶液的配置體積,因此
配成1升時,溶質質量=0.5Mx1Lx40=20克
先取20克NaOH溶質置於容量瓶中,以適量的水先溶解,再加水至1公升刻度。
配成100毫升時,溶質質量=0.5Mx0.1Lx40=2.0克
先取2克NaOH溶質置於容量瓶中,加適量水先溶解,再加水至100毫升刻度。
配成50毫升時,溶質質量=0.5Mx0.05Lx40=1.0克
先取1克NaOH溶質置於容量瓶中,加適量水先溶解,再加水至50毫升刻度。
( )41. 某化學工廠之廢水中含有Cu2+的重量百分率為5 ´ 10 - 5%。此廢水中Cu2+含量應為:
(A)0.05 ppm (B)0.5 ppm (C)5 ppm (D)50 ppm。
【答案】: (B)
【解析】:百萬分點濃度=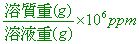
重量百分率為5 ´ 10 - 5%,表示100克溶液中有5 ´ 10 - 5克的溶質固體
因此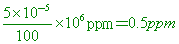
( )42. 將某物質10%及17%的水溶液,混合成12%的水溶液,則兩者混合質量的比,下列何者正確?
(A)2:3 (B)5:1 (C)3:2 (D)5:2。
【答案】: (D)
【解析】:假設10%溶液X克及17%溶液Y克,則:
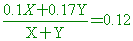 0.1X+0.17Y=0.12X+0.12Y 0.1X+0.17Y=0.12X+0.12Y
0.02X=0.05Y è X:Y=0.05:0.02=5:2
( )43. 濃鹽酸比重為1.20,重量百分率濃度為36.5%,今欲配製3.0M的HCl溶液1.0升,則:
(A)取250毫升的濃鹽酸加到750毫升水中 (B)取250毫升的濃鹽酸溶解於水中後,再加水到溶液為1.0升 (C)取109克的濃鹽酸溶解於1.0升的水中 (D)取109克的濃鹽酸加入891克水中。
【答案】: (B)
【解析】:溶質HCl莫耳數=3.0Mx1.0L=3(mol) HCl分子量=1+35.5=36.5
溶質質量=3x36.5=109.5克 取濃鹽酸VmL,則:
Vx1.2x0.365=109.5 V=250mL
取250mL的36.5%濃鹽酸,先加入適量水溶解,再將體積稀釋至1.0L。
( )44. 已知BaCl2在70℃與50℃之溶解度分別為25克/100克水,10克/100克水,今有250克飽和溶液從70℃冷卻到50℃,可析出BaCl2•2H2O晶體若干克?(Ba = 137,Cl = 35.5)
(A)30克 (B)35.8克 (C)39.2克 (D)42.4克。
【答案】: (B)
【解析】:BaCl2•2H2O晶體分子量=(137+35.5x2)+2(18)=208+36=244
70℃時,溶液的溶解度=25克溶質,100克水,溶液共125克
70℃時,250克的飽和溶液25:125=X:250 X=50克溶質
250-50=200克水
降至50℃時,部分溶質和結晶水析出,因此水量會減少。
假設有W克的晶體(水合物)析出,則在50℃時,
100克水最多可以溶解10克,溶液成為110克
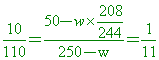 250-w=550-9.38w 250-w=550-9.38w
300=8.38w w=35.8克(含結晶水)
( )45. 有關溶解度的敘述,何者正確?
(A)液體溶於液體溶解度,大都因本性而不同 (B)固體的溶解度都隨溫度升高而增大 (C)氣體溶解度與其平衡存在氣體壓力成反比 (D)氣體溶解度隨溫度升高而增大。
【答案】: (A)
【解析】:(A)不同種類的物質,溶解度不相同,與物質的本性有絕對相關。
(B)溶解過程吸熱的物質,當溫度升高時,有利於溶解速率;
溶解過程放熱的物質,當溫度升高時,則不利於溶解`。
(C)壓力愈大時,氣體的溶解度亦隨之愈大,兩者呈成正比。
(D)溫度愈高時,氣體的溶解度亦隨之減少,升高溫度不利於溶解。
( )46. 下列何者與氣體在水中的溶解度較無關係?
(A)水中的溫度 (B)氣體的壓力 (C)氣體的種類 (D)氣體的體積。
【答案】: (D)
【解析】:(A)溫度升高時,氣體的溶解度會減小。
(B)溫度一定時,氣體的溶解度隨著壓力的增加而增大,因此壓力愈大,氣體溶解愈多。
(C)不同的氣體,溶解度不相同,有些氣體(如:NH3,HCl)極易溶於水,但也有些氣體難溶於水(如:O2、N2、H2等)
(D)氣體的體積與氣體溶解度無關。
( )47. 重量比以1:4混合之NaCl和KNO3混合鹽,想以結晶方法得KNO3,作下述操作時所得的KNO3純度約為多少?
【操作方式】以80 熱水100克將上述混合鹽溶解,然後將沒有溶解部分過濾,所得濾液冷卻至20 熱水100克將上述混合鹽溶解,然後將沒有溶解部分過濾,所得濾液冷卻至20 可得KNO3晶體,本題有關水蒸發及結晶水忽略不計,又二種鹽類溶解度(克/100克水)表示如下表: 可得KNO3晶體,本題有關水蒸發及結晶水忽略不計,又二種鹽類溶解度(克/100克水)表示如下表:
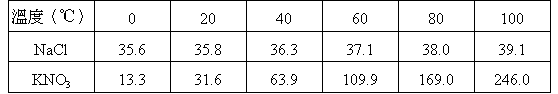
(A)91.5% (B)95.3% (C)98.4% (D)99.9%。
【答案】: (C)
【解析】:判斷溶解的質量,100克水,80℃時,最多只能溶KNO3169克
若加入硝酸鉀KNO3169克,則NaCl只能加入42.25克,但NaCl只能溶解38.0克,因此NaCl會有部分沉澱產生,依題意,將沉澱過濾,
若加入NaCl38.0克恰好完全溶解,則加入KNO3的質量=38.0x4=152克
但KNO3最多能溶解169克,因此KNO3仍未飽和,因此不會有沉澱產生,與題意不合。
另若設取38克
NaCl,則KNO3為38 ´ 4 =152(克),對KNO3而言未飽和,並無剩餘固體可過濾,故不合題意,
∴ 第一次的假設正確
將溶液冷卻至20℃時,100克的水只能溶解NaCl 35.8克,
因此NaCl將有38.0-35.8=2.2克沉澱
而KNO3最多能溶解31.6克,因此結晶將有169 - 31.6 = 137.4克沉澱
所以沉澱中含KNO3的純度為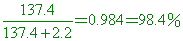
( )48. 在40℃時硫酸銅之溶解度為50克/100克水,今於40℃時在某硫酸銅飽和溶液內置入一些無水硫酸銅粉末,發現析出50克CuSO4•5H2O晶體且溶液仍維持飽和狀態,則置入之無水硫酸銅粉末為若干克?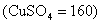
(A)23 (B)25 (C)28 (D)32。
【答案】: (A)
【解析】:40℃時硫酸銅之溶解度為50克/100克水,溶液質量為150克
硫酸銅固體:水:硫酸銅溶液=50:100:150=1:2:3
析出50克CuSO4•5H2O晶體,含CuSO4固體=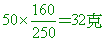
水合物中含結晶水50-32=18克,因此
假設原來的飽和溶液中含a克的固體,2a克的水,成為3a克的溶液,
若加入X克的無水流酸銅後,固體(溶質)的總質量增加,溶液的總質量增加,
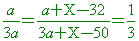 交叉相乘, 3a+3X-96=3a+X-50 交叉相乘, 3a+3X-96=3a+X-50
3X-X=96-50
2X=46 X=23克
( )49. 於80℃時,100克水中溶入無水硫酸銅粉末至飽和狀態,再將此溶液蓋上蓋子,慢慢冷卻至25℃時,析出CuSO4•5H2O的克數約為若干?(已知80℃及25℃之溶解度分別為48及23克CuSO4/100克H2O,原子量Cu = 64,S = 32)
(A)20 (B)30 (C)45 (D)50。
【答案】: (C)
【解析】:CuSO4•5H2O分子量=(64+32+16x4)+5(1x2+16)=160+90=250
80℃時,100克水最多能溶解硫酸銅48克,成為溶液148克
降至25℃時,溶解度降低,部分的水和固體和成水合物結晶析出。
假設析出的硫酸銅晶體X克(水合物),其中含硫酸銅固體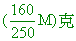
因此 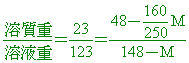 3404-23M=5904-78.72M 3404-23M=5904-78.72M
55.72M=2500 M=44.9克
( )50. 以CaCl2•6H2O(s)配製5%氯化鈣水溶液222公克,應取該水合物若干克?(Ca = 40,Cl = 35.5)
(A)21.9 (B)26.6 (C)31.2 (D)37.4。
【答案】: (A)
【解析】:5%氯化鈣水溶液中含溶質222x0.05=11.1克
CaCl2•6H2O分子量=(40+35.5x2)+6(1x2+16)=111+108=219
取水合物M克,則 Mx(111/219)=11.1 M=21.9克
|