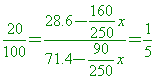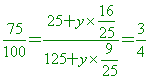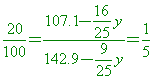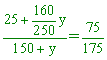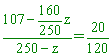|
|
|
1.
(1)欲使15%的NaOH溶液 【答案】:(1)400克; (2)0.1M 【解析】:(1)設需加5%的NaOH溶液x克,則 2.
取 【答案】: 【解析】:CuSO4×5H2O=160+5x18=160+90=250 3.
取 【答案】:[Na + ] = 【解析】:16.4克的Na3PO4莫耳數= 4.
某鹽在 【答案】:160克 【解析】:100克水能溶解75克的溶質,溶液質量=100+75=175克 5.
5. 【答案】:25.2克 【解析】:60°C時,100克水溶解40克CuSO4,溶液為140克 6.
硝酸鉀(KNO3)在的溶解度為 【答案】:660克 【解析】: 7.
KNO3對水的溶解度,在 【答案】: 145.5克 【解析】: 8.
師大附中一游泳池:長 【答案】:52.8升 【解析】:游泳池水量體積=50x25x2=2500 m3, 9.
比重1.2含21%的HCl水溶液200毫升和 【答案】:6.36 M 【解析】:溶液質量=200x1.2=240克 ; 溶質質量=240x0.21=50.4克 10.
取 【答案】:(1)16%; (2)0.021 【解析】:CuSO4 ×5H2O分子量=160+90=250 |
|
11.
已知CuSO4對水溶解度在 【答案】:(1) 【解析】:(1) 20°C時,100克水最多溶解20克溶質,溶液為120克 12.
取 123 g 的 MgSO4.7H2O 溶於 100 g 水中,成為比重 1.115 溶液,試求此溶液的: 【答案】:(1) 26.9%; (2) 【解析】:MgSO4.7H2O的分子量=[(24+32+16x4)+7x(12+16)]=120+126=246 13.
下表是 CuSO4 的溶解度,據表計算下列問題:(式量:CuSO4 =160) (1) (2) 80 ℃的 CuSO4 之飽和溶液 250 g,冷卻至 20 ℃時,可以析出 【答案】:(1) 185.8 g; (2) 【解析】: (1) CuSO4•5H2O分子量=160+90=250 14.
於密度 【答案】:12 % 【解析】:葡萄糖水溶液質量=100x1.2=120克,含溶質葡萄糖質量=120x0.2=24克 15.
製造肥皂時,需使用到 【答案】:32克 【解析】:所需的氫氧化鈉莫耳數=MxL=8x0.1=0.8莫耳 16.
將 【答案】:0.31M 【解析】:溶質NaOH莫耳數=0.5x0.15+0.2x0.25=0.125莫耳 17.
某化學工廠排出的廢水中,含有Hg2+
3 ppm,,則此廢水中之Hg2+ 的重量百分率濃度應為若干?體積莫耳濃度為若干M?(假設工廠廢水的密度約為 【答案】:(1) 3x10-4 % (2)1.49x10-5M 【解析】:3ppm=106克的廢水中約含有Hg2+
3克=1m3(1000L)的廢水中約含有Hg2+ 3克; 18.
KNO3經測定在 【答案】:須取KNO3 【解析】:60 ℃的飽和KNO3 溶液含有 19.
已知在 【答案】: (1) 37.5 %; (2) 4.13
M; (3) 0.097 【解析】:溶質重=60克,溶液重=100+60=160克,溶液體積= |