|
基礎化學1-2(加強班練習題) |
|||||||||
|
一、單選題: ( )1. A、B二元素生成化合物X、Y,0.3克A+0.4克B → 0.7克X;1.8克A+4.8克B → 6.6克Y,若X之化學式為AB,則Y之化學式為: 【解答】:(A) 【解析】:0.3克A+0.4克B → 0.7克X A質量:B質量:X質量=3:4:7; ( )2. 下列何組可用來修正道耳頓原子說中:「不同元素具有不同的質量」? 【解答】:(D) 【解析】:(A)石墨、金剛石成分都是碳,為同素異形體; (B) 12C、13C都是碳的同位素; ( )3. 下列哪一種反應,不能用道耳頓的原子說加以說明? 【解答】:(C) 【解析】:一般的化學反應都遵守道耳頓的原子說,但是(C)n+U →Ba+Ky+3n 為核反應,不是一般的化學反應,不遵守質量守恆,也不遵守原子不滅。 ( )4. 已知2A+B → 3C,取14克的A和12克的B,經充分反應後,B剩下6克,則產生C若干克? (A) 19 (B) 20 (C) 18 (D) 6 【解答】:(B) 【解析】:2A+B → 3C,充分反應後,B剩下6克,表示A共消耗14克,B則消耗12-6=6克; ( )5. 已知N及O兩元素可合成NO、N2O5及NO2三種化合物,今若欲以相同質量的氮氣來合成上述三種化合物,則所需氧氣用量的比依序應為 【解答】:(A) 【解析】:NO、N2O5及NO2三種化合物,將Nˋ質量化成相同時,成為N2O2、N2O5及N2O4, ( )6. 已知化合物Ⅰ及Ⅱ均含氮及氟,分析化合物Ⅰ 23.67克知含氟19克,化合物Ⅱ 26.0克含氮7.0克,若化合物Ⅰ之分子式為N2F3,則化合物Ⅱ之分子式可能為: 【解答】:(D) 【解析】:化合物Ⅰ 23.67克知含氟19克,因此化合物Ⅰ中,N:F=(23.67-19):19=4.67:19
( )7. 已知化合物Ⅰ及Ⅱ均含氮及氟,分析化合物Ⅰ 23.67克知含氟19克,化合物Ⅱ 26.0克含氮7.0克,若化合物Ⅰ之分子式為N2F3,則化合物Ⅱ之分子式可能為: 【解答】:(D) 【解析】:化合物Ⅰ 23.67克知含氟19克,因此化合物Ⅰ中,N:F=(23.67-19):19=4.67:19
( )8. 化合物X2Y4中,X重量百分組成為87.5%,則化合物XY3中X、Y兩元素組成質量比X:Y= 【解答】:(B) 【解析】:
因此X質量:Y質量=43.75:9.375=4.67:1=14:3。 ( )9. 已知化合物甲由元素X與Y以質量比3:5組成,化學式為X2Y,今有化合物甲20公斤,則其中所含的元素X有多少公斤? 【解答】:(C) 【解析】:化合物甲由元素X與Y以質量比3:5組成,X質量佔全部的 ( )10. 已知磷和氯可形成化合物I及化合物II,其中化合物I含有14.87%的磷,化合物II含有77.45%的氯,若化合物I的化學式為PCl5,則化合物II的化學式可表為 【解答】:(B) II 【解析】: ( )11. 今有二種不同元素X及Y,化合為兩個含此二種元素的化合物。第一個化合物是由9.34克的X和2.00克的Y化合而成;而第二個化合物是由4.67克的X和3.00克的Y化合而成。如果第一個化合物的分子式是XY,那麼第二個化合物的分子式為下列何者? 【解答】:(D) 【解析】: ( )12. 元素X和Y形成化合物Ⅰ和Ⅱ,Ⅰ含Y重量60%,Ⅱ含X重量50%,則Ⅰ、Ⅱ依次的下列化學式組合,何者不妥? 【解答】:(B) 【解析】: ( )13. 化合物X3Y2中X的含量百分率為40%,則X、Y兩元素之原子量比X:Y=? 【解答】:(D) 【解析】: ( )14. 反應2A+B → C,當取10克A和6克B充分反應後,A完全耗盡,但B剩餘1克,求反應時A、B、C三者分子量比? 【解答】:(B) 【解析】: ( )15. 甲、乙、丙均為氣體,在同溫同壓下,2體積甲和1體積乙化合成2體積丙,若甲的化學式為A2,則乙的化學式可能為何? 【解答】:(C) 【解析】: ( )16. 甲氣體1升,剛好能與乙氣體3升化合,以產生丙氣體2升。若甲氣體的分子式為A3(即三原子分子),則乙氣體的分子式可能是下列的哪一個? 【解答】:(C) 【解析】: ( )17. 同溫同壓下,若10毫升的NH3分子含x個原子,則多少毫升的H2亦含有x個原子? 【解答】:(D) 【解析】: ( )18. 同溫同壓下,若10毫升的甲烷分子含x個原子,則多少毫升的氮氣亦含有x個原子? 【解答】:(C) 【解析】: ( )19. 同溫同壓下,氣體甲2.0升重1.20克,氣體乙1.0升重0.64克。已知乙氣體為氧氣,而甲僅由氧和氮兩元素結合組成,則下列何者為甲氣體的化學式?(原子量:N=14,O=16) 【解答】:(B) 【解析】: ( )20. 【解答】:(B) 【解析】: ( )21. 【解答】:(A) 【解析】: ( )22. 【解答】:(C) 【解析】: ( )23. 兩種化合物X與Y,生成兩種化合物C1和C2,每種化合物重量百分組成如附表所示,若C1的化學式為XY4,則C2的化學式為: 【解答】:(D) 【解析】: ( )24. 有關原子與原子量的敘述,下列何者正確? 【解答】:(D) 【解析】: ( )25. 有關道耳頓的「原子論」,下列何項敘述錯誤? 【解答】:(D) 【解析】: ( )26. 定比定律是基於何種單位而能知道化合物中的組成? 【解答】:(A) 【解析】: ( )27. 某化合物A2B3 15.0克中含有B 4.5克,另一含A、B之化合物中,B占重量16%,其化學式可能為? 【解答】:(A) 【解析】: ( )28. 某化合物之化學式為A2B3,且10克的A2B3中含有3.33克的B元素,另一僅含A、B兩元素之化合物X中,B的重量百分率為25%,則X之化學式可能是: 【解答】:(A) 【解析】: ( )29. 某些元素可以與氧形成多種氧化物,若元素A與氧形成AO與AO2兩種化合物,且已知3莫耳AO的原子數與92克AO2的原子數目相同,則AO的分子量是多少? 【解答】:(A) 【解析】: ( )30. 若化合物A2B的重量百分率組成為60%A與40%B,則化合物AB2的重量百分組成,與下列何組重量百分組成最接近? 【解答】:(A) 【解析】: ( )31. 若兩種元素M及X形成兩種化合物:MX2及MX3,其中X之重量百分比分別為a%及b%,則a與b之數學關係式為: 【解答】:(D) 【解析】: ( )32. 鉛之兩種氧化物,經分析得知其中分別含鉛92.83%和89.62%,則當其所含之氧重相等時,所含之鉛量比約為下列何者? 【解答】:(A) 【解析】: ( )33. (甲) 0.1莫耳的氦氣;(乙) 0.1克的水;(丙) 6.02×1020個C6H12O6分子;(丁) 3.01×1022 Da的銀。以上四種物質的質量大小順序為:(原子量:C=12.0,H=1.0,O=16.0,He=4.0,Ag=108) 【解答】:(D) 【解析】: ( )34. 「原子量」指的是? 【解答】:(D) 【解析】: ( )35. NA代表亞佛加厥數,即1莫耳物質的粒子個數,有關NA的敘述何者正確? 【解答】:(D) 【解析】: ( )36. 下列何者含有碳原子的個數最少?(原子量Ca=40,C=12,O=16,H=1) 【解答】:(D) 【解析】: ( )37. 下列何者具有最多量的氧原子? 【解答】:(D) 【解析】: ( )38. 下列何者所含的原子數最少?(原子量:Hg=200,Cr=52) 【解答】:(D) 【解析】: ( )39. 下列哪一物質的數量恰為1莫耳?(原子量:C=12.0,H=1.0,N=14.0,O=16.0) 【解答】:(E) 【解析】: ( )40. 下列哪一組物質是屬於同位素的關係? 【解答】:(D) 【解析】: ( )41. 下列關於「莫耳」的敘述,何者正確? 【解答】:(C) 【解析】: ( )42. 下列關於物質的敘述何者正確? 【解答】:(C) 【解析】: ( )43. 已知化合物甲由元素X與Y以質量比3:5組成,化學式為X2Y,今有化合物甲20公斤,則X、Y兩元素的原子量比應為: 【解答】:(A) 【解析】: ( )44. 已知自然界中B占20%、B占80%;則下列何者為硼之平均原子量? 【解答】:(C) 【解析】: ( )45. 已知亞佛加厥數為6.02×1023。下列哪一項所含氫的原子數最多? 【解答】:(D) 【解析】: ( )46. 天然的氯35Cl及37Cl兩種同位素,氯原子的平均原子量為35.5,則兩種同位素在自然界中的含量比為何? 【解答】:(B) 【解析】: ( )47. 比較下列四個例子中質量的大小:(甲) 2個乙烷分子(C2H6);(乙) 54 amu水分子;(丙) 10克水;(丁) 1×10-21莫耳的乙烷。(原子量:C=12,O=16,H=1) 【解答】:(C) 【解析】: ( )48. 【解答】:(A) 【解析】: ( )49. 在下列幾種微粒中,已知a、b、c不相等,則其中互為同位素的是 【解答】:(A) 【解析】: ( )50. 在同溫同壓下,CO與CO2兩氣體中的原子數比為3:2,則下列何者正確? 【解答】:(D) 【解析】: ( )51. 如果銅元素的原子量是63.5,則自然界中銅的同位素 6329Cu和 6529Cu之原子個數比為何? 【解答】:(A) 【解析】: ( )52. 有甲、乙兩種氣體,各重1.64克及0.5克。在同溫同壓時,甲氣體之體積為乙氣體之2倍,若知乙氣體之分子量為28,則下列分子何者可能為甲氣體?(N=14) 【解答】:(A) 【解析】: ( )53. 有某定量的CH4及H2O,已知兩者所含原子總數相同,則下列有關兩者各項比較關係,何者正確?(原子量:C=12.0,H=1.0,O=16.0) 【解答】:(D) 【解析】: ( )54. 自然界中元素R存在24R、25R、26R三種同位素,已知25R、26R之含量相等,且元素R的平均原子量為24.3,試求24R在自然界的含量約為多少? 【解答】:(A) 【解析】: ( )55. 自然界中存有20Ne和22Ne兩種同位素,而氖的平均原子量為20.2,由此推知氖22Ne在自然界中含量約為 【解答】:(B) 【解析】: ( )56. 自然界之氯有兩種同位素:35Cl(原子量:34.97 amu)和37Cl(原子量:36.97 amu),其原子量為35.45,則37Cl的含量百分率(%)約為: 【解答】:(B) 【解析】: ( )57. 依照質量的大小順序排列下列各項:(1) 10-2莫耳水(H2O);(2) 3個鋁原子(Al);(3) 10-3克臭氧(O3);(4) 0.1莫耳的鹽酸(HCl)(Al=27,Cl=35.5) 【解答】:(A) 【解析】: ( )58. 取某元素40公克,其原子總數為3.01×1023個,則該元素的原子量為若干? 【解答】:(C) 【解析】: ( )59. 金屬錫之同位素中,其一同位素有50個質子和63個中子,下列敘述中,何者為錫的另一同位素? 【解答】:(C) 【解析】: ( )60. 某些元素可以與氧形成多種氧化物,若元素A與氧形成AO與AO2兩種氧化物,且已知3莫耳AO的原子數目與92克AO2的原子數目相同,則AO的分子量是多少克? 【解答】:(A) 【解析】: |
|||||||||
|
二、多重選擇題: ( )1.
下列敘述,何者可說明定組成定律? 【解答】:(C)(E) 【解析】:(A)乙醇(C2H5OH)和二甲醚(CH3OCH3)有相同的分子式(C2H6O),但是結構排列不相同,因此性質不相同,稱為同分異構物。 ( )2.
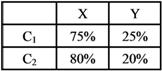
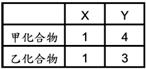
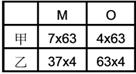
【解答】:(A)(B)(E) 【解析】:由表中化簡可得: ( )3.
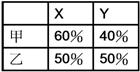
元素X與Y所成之化合物中含40%X與60%Y,已知X原子量為Y之兩倍,則其可能化學式為 【解答】:(A)(E) 【解析】:假設Y的原子量為m,則X的原子量為2m。 ( )4.
有關各學說、定律的敘述,下列何者正確? 【解答】:(B)(D) 【解析】:(A)”普魯斯特”提出定比定律,說明元素間相互化合時,質量間具有一定比例關係。 ( )5.
有關道耳頓的原子說,以現今的觀點來看,下列何者不正確? 【解答】:(B)(C)(E) 【解析】:(A)(D)道耳頓的原子說主張在化學反應前後,原子不生不滅,只是重新排列,可以解釋質量守恆定律。 ( )6.
有關道耳頓原子說的敘述,何者正確? 【解答】:(A)(B) 【解析】:(A) 道耳頓主張組成物質最小的粒子為原子。 ( )7.
實驗一:5克的A元素與8克的B元素,反應完全後得到9克的化合物C;實驗二:1克的A元素與20克的B元素,反應完全後亦得到9克的化合物C。根據原子說,針對上述兩組實驗,下列結論何者正確? 【解答】:(B)(E) 【解析】:A和B反應產生C物質,任何的化學反應,必定遵守質量守恆,因此(A)錯誤。 ( )8.
下列有關同位素的敘述,何者正確﹖ 【解答】:(A)(D)(E) 【解析】:(A)同位素指相同的質子數,但有不同的中子數,因此原子序相同,為同一元素,因此化學性質相同。 ( )9.
下列有關莫耳的敘述,何者正確? 【解答】:(A)(C)(D)(E) 【解析】:(A) 1莫耳的個數,代表一個大數,其數值為6.02×1023。 ( )10.
下列有關莫耳觀念的敘述,何者為正確? 【解答】:(A)(C)(D)(E) 【解析】:1莫耳=1mol=1克原子=6.02x1023個粒子。 ( )11.
下列何種物質所含原子總數與3.20克的甲烷相同?(原子量:O=16,N=14,He=4;亞佛加厥數=6.02×1023) 【解答】:(B)(C)(E) 【解析】:甲烷CH4的分子中含有5個原子,而分子量=12+1x4=16; ( )12.
下列何種物質所含原子總數與3.2公克的CH4相同?(原子量:N=14,He=4) 【解答】:(B)(C)(D)(E) 【解析】:(A) NO2=14+16x2=46,2.30克之NO2= ( )13.
下列數值何者為亞佛加厥數? 【解答】:(C)(D)(E) 【解析】:亞佛加厥數為6.02x1023個粒子,級為1莫耳的粒子數目,簡寫為NA。 ( )14.
下列質量大小分別為(甲) 2個乙烷分子;(乙) 3個水分子;(丙) 10-21克的水;(丁) 1克氧原子;(戊) 1克原子氧,則質量大小順序為: 【解答】:(A)(D) 【解析】:甲(乙烷分子,C2H6)分子量=12x2+1x6=30:2 × 30=60(amu);乙:3 ×
18=54(amu);丙:10-21 × 6 × 1023=600(amu);丁:6 ×
1023(amu);戊:32 g Þ 戊>丁>丙>甲>乙 ( )15.
已知NH3之分子量為17,則下列敘述,何者正確(N=14)? 【解答】:(A)(C)(D) 【解析】: ( )16.
【解答】:(A)(B)(C) 【解析】: ( )17.
已知氯在自然界有兩種同位素:35Cl和37Cl,其原子量分別為34.98和36.98,經計算得知氯的平均原子量為35.45,則下列敘述何者正確? 【解答】:(A)(C)(E) 【解析】: ( )18.
某氣體試料於1.00 L容器中至S.T.P.時,測其重量為1.34克,在此狀況下此氣體試料可能為: 【解答】:(A)(B)(C)(E) 【解析】: ( )19.
欲將二種氣體以等體積混合成氣體密度為乙烷的1.20倍時,應取下列何種組合? 【解答】:(A)(D) 【解析】: ( )20.
硫有四種同位素:S-32、S-33、S-34、S-36,它們四個具有相同的何種性質? 【解答】:(A)(C)(E) 【解析】: |
|||||||||
|
三、非選擇題: 1.
同溫同壓時,N2O(g)和NO(g)含有同數目的原子,則下列比值分別為何? 【解答】:(1) 莫耳數比=2:3; (2) 氣體的體積比=2:3 (3)所含氧原子個數比=2:3。 【解析】:N2O(g)和NO(g)皆為氣體,遵守亞佛加厥定律: 2.
有甲、乙兩化合物,均由A、B兩元素組成,已知60克的甲中含有45克的A,而30克的乙中含有10克的B。若化合物甲的化學式為A3B,則試以最簡單整數比的關係表示出化合物乙的化學式? 【解答】:乙最簡單的化學式將為A2B。 【解析】:60克的中含45克的A、15克的B;30克的乙中含20克的A、10克的B。 3.
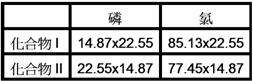
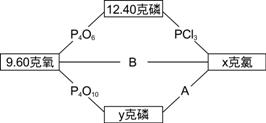
【解答】:X=42.6克, y=7.44克, 【解析】:X: P:Cl= 4.
某生利用鹽酸和大理石製得二氧化碳,經分析後發現二氧化碳中含碳百分率為27.3%,若該生亦由加熱碳酸氫鈉獲得二氧化碳66克,則該二氧化碳中含有多少克的氧? 【解答】:47.98克 【解析】:鹽酸和大理石製得二氧化碳,CaCO3+2HCl→CaCl2+H2O+CO2 5.
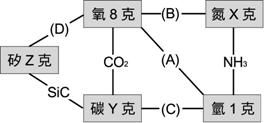
【解答】:A=H2O, B=N2O3,C=CH4, D=SiO2; 【解析】: 1克的H和8克的O組成(A), 6.
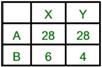
A、B、C三種化合物均含有Q元素,經分析結果如附表,試求Q元素之原子量 【解答】:19 【解析】:A中Q的含量=152x0.5=76, B中Q的含量=100x0.38=38, 7.
n A+m B → x C+Q Kcal,已知A之分子量為24,C之分子量為72,則: 【解答】:
【解析】:(1)
n莫耳的A和m莫耳的B反應產生x莫耳的C,24n+mB=72x 8.
X2Y5中含60.0% X與40.0% Y(重量%),則X之原子量為Y之幾倍? 【解答】:3.75倍 【解析】:X的原子量為x,Y的原子量為y,則 9.
【解答】:A2B6或是AB3。 【解析】:將X、Y物質的A元素質量化成相同,假設X的化學式為A2By,則: 10.
甲、乙兩化合物均由X、Y兩元素組成,其重量百分組成甲為20% X和80% Y,乙為25% X和75% Y,已知乙的化學式為XY2,則甲的化學簡式為何? 【解答】:甲化學式=X3Y8 【解析】:假設甲的化學式為XYm,化合物的組成元素質量化簡,使x的質量相同,則: 11.
某元素(M)和氧形成二種化合物甲(化學式為M2O)和乙。甲4.4克中氧占1.6克,乙中氧重量占63%,則乙的化學式為何?
【解答】:M2O3 【解析】:甲4.4克中氧占1.6克,M佔4.4-1.6=2.8。假設乙的化學式為MxO 12.
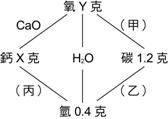
經由測量得知化合物A含40 %元素X,60 %元素Y。化合物B中含25 % X及75 % Y,按照倍比定理,在化合物A及B中,其含有元素Y的重量之比為何? 【解答】:1:2。 【解析】:將AB兩化合物的組成元素XY質量關係,列成表, 13. 試依據定比定律,推算下圖中:(原子量:C=12.0,O=16.0,Ca=40.0) 【解答】:X=8.0克,
Y=3.2克,甲=CO2;乙=CH4;丙=CaH2。
14.
0.20莫耳的硫酸(H2SO4)分子的質量為 克,其中含有O原子 個。 【解答】:(1) 19.6克; (2) 4.816x1023個O原子。 【解析】:H2SO4分子量=1x2+32+16x4=98 0.2mol 的H2SO4質量=0.2x98=19.6克; 15.
已知8.5公克的氨,32公克的二氧化硫和16公克的氧,在同溫同壓下其所占體積均相同,已知氧的分子量為32,則:(S=32) 【解答】:(1)17、64; (2) 6.02x1023個氨氣分子;
(3) 3.01x1023個S原子、6.02x1023個O原子; 【解析】:同溫、同壓下,氣體的體積均相同,則分子數必定相同,莫耳數必定相同。 16.
已知某元素X極不活潑,在它的原子中有90%的原子質量為20,另外10%的原子質量為22。試回答下列問題: 【解答】:(1) C; (2)20.2 【解析】:(1)
同一元素有相同的質子,但是不同的質量,稱為同位素,由於中子數不同所造成。 17.
已知溴有兩種天然同位素:溴-79天然含量50.7%及溴-81天然含量49.3%,則溴的平均原子量為若干? 【解答】:80.0 【解析】:平均原子量按照含量比例的加權平均值計算。 18.
已知蔗糖分子式為C12H22O11,今由一杯蔗糖水溶液結晶析出239.4克的蔗糖,請依上述結果,回答下列問題:(原子量:C=12.0,H=1.0,O=16.0) 【解答】: 【解析】:(1)
C12H22O11的分子量=12x12+22x1+11x16=342 莫耳數= 19.
全球暖化現象加劇,二氧化碳排放量成為暖化程度的指標,透過下列問題的引導,你可以知道每公升的汽油大約會產生多少的二氧化碳。若以辛烷C8H18代表汽油的組成分,已知辛烷的比重為0.7,則:(原子量:C=12.0,H=1.0) 【解答】:(1) 6.14莫耳; (2)
589.44克; (3) 2.16公斤 【解析】:(1)體積1公升的辛烷=1000cm3,密度0.7g/cm3,則質量=1000x0.7=700克 20.
試求下列分子的分子量各為若干?(原子量:C=12,H=1,O=16,S=32,N=14,Na=23) 【解答】:(1) 342;(2) 98;(3) 17;(4) 46;(5) 44;(6) 180;(7) 142;(8) 60 【解析】:(1)蔗糖(C12H22O11)=12x12+1x22+16x11=144+22=176=342。 21. 碳的同位素包括碳-12及碳-13,其質量及含量如下表:試由表中數據,計算碳元素的平均原子量。 【解答】:12.01 【解析】:C的平均原子量=12x0.989+13x0.011=12.01 22.
請問49公克的硫酸(H2SO4): 【解答】:(1) 0.5; (2)
3.01×1023; (3)
1,6.02×1023; (4)
0.5,3.01×1023 【解析】:(1)硫酸分子量=98,莫耳數=49/98=0.5莫耳; 23.
下列何者所含的碳原子數最多? 【解答】:(丙) 1 M的葡萄糖(C6H12O6)溶液0.5升 【解析】:(甲) 0.2莫耳的丙烷(C3H8)含C莫耳數=0.2x3=0.6莫耳C原子。 24.
依照質量大小排列下列各項。(a) 1個銅原子;(b) 1´10-21莫耳銅;(c) 1´10-2莫耳水;(d) 6個水分子(Cu=63.5) 【解答】:(c) 1´10-2莫耳水 > (b) 1´10-21莫耳銅 > (d)6個水分子 > (a) 1個銅原子 【解析】:(a) 1個銅原子=63.5amu=63.5x1.67x10-24克=1.06x10-22克。 25.
某元素有兩種同位素。一種為X,質量為10.0129 amu,佔19.91 %;另一種為X,質量為11.0093 amu,佔80.09 %。根據以上資料,回答下列各題。 【解答】: 【解析】: 26.
乾燥空氣中主要含有20%的氧氣和80%的氮氣,試回答下列問題: 【解答】: 【解析】: 27.
排出下列各物質質量的大小順序。 (A) 6.02×1023個水分子 (B)1莫耳C原子 (C) 10克的CO2 (D) 0.2 M 5升鹽酸溶液中含HCl的質量(Cl原子量35.5) (E) 12% NaOH溶液200克中含NaOH的質量 【解答】: 【解析】: 28.
試計算Ca(NO3)2的式量及CH3OH的分子量。 【解答】: 【解析】: 29.
試將下列五種物質依照質量由大而小的順序排列。(原子量:H=1.0;O=16;N=14;S=32;Al=27;Mg=24.3) 【解答】: 【解析】: 30.
試將下列五種物質依照質量由大而小的順序排列之。(原子量:N=14,Cu=63.5,Ne=20) 【解答】: 【解析】: 31.
.某元素有三種同位素,其質量分別為y-3、y、y+1,三者的平均原子量為y,則質量為y+1的同位素最大含量不能超過75%,試證之。 【解答】: 【解析】: 32.
0 ˚C、l atm下,22.4公升的氧氣所含分子數為x個,4 ˚C、l atm下,22.4公升的純水所含的分子數為y個,則x=______,y =______。 【解答】: 【解析】: 33.
求0.5 mol的Al2 (CO3)3的質量為若干公克?(原子量:Al=27,C=12,O=16) 【解答】: 【解析】: 34.
將下列四種物質依照質量由大而小的順序排列之:(甲) 2個銅原子;(乙) 0.1莫耳銅;(丙) 30000個水分子;(丁) 0.5公克的氧氣。(原子量:Cu=64)______。 【解答】: 【解析】: |