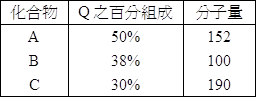|
|
|||||||||||||||||||||||||
|
(一)
原子說及其基本定律: A.
原子與分子:物質是由分子構成,而分子由原子所構成。
(1) 原子: 甲、 一切物質是由原子所組成,但是原子並不一定能表現出物質的特性。 乙、 金屬是由原子堆積而成,惰性氣體是以單原子的形式存在自然界,因此這類的原子能表現出物質的特性。 丙、 非金屬的石墨是由碳原子組成,組成的碳原子排列成平面結構,與同樣是由碳原子排列成立體結構的鑽石性質不相同。
(2) 分子: 甲、 分子是由原子所組成,自然界有許多物質是由兩個或兩個以上的原子所組成,這些由原子組成,而具有物質特性的粒子,稱為分子。 乙、 單原子分子: (a)
一個原子單獨存在自然界,而具有物質的性質,稱為單原子分子。 (b)
如惰性氣體(鈍氣):氦(He)、氖(Ne)、氬(Ar)、氪(Kr)、氙(Xe)、氡(Rn)。 丙、 雙原子分子: (a)
由兩個原子所組成的物質,稱為雙原子分子。 (b)
氫氣(H2)、氧氣(O2)、氮氣(N2)、氟(F2)、氯(Cl2)、溴(Br2)、碘(I2)。 (c)
一氧化碳(CO)、氧化鎂(MgO)、硫化銅(CuS)、氧化鋅(ZnO)、氯化氫(HCl)…。 丁、 多原子分子: (a)
多個原子組成的分子,稱為多原子分子。 (b)
臭氧(O3)、氨氣(NH3)、二氧化碳(CO2)、過氧化氫(H2O2)、硫酸(H2SO4)…。 B.
質量守恆定律:1785年,(法)拉瓦節
(1) 化學反應前後,各物質原子不滅,質量總和相等。 C.
定比定律:1799年,(法)普魯斯特
(1) 同一種化合物,無論來源或製造方法,所含各成分元素間的質量比為定值。 D.
倍比定律:1804年,(英)道耳吞
(1) 二種原子構成不同的化合物時,令一原子質量固定,則另一原子質量成簡單整數比。
(2) 僅適用於2種原子的化合物,不適用於二種原子以上之化合物。
(3) C、O可形成CO、CO2,其中若將C的質量固定,則O的質量比為1:2。
(4) H、O可形成H2O、H2O2,其中若將H的質量固定,則所需O的質量比為1:2。
(5) S和O可形成SO2、SO3,若將S的質量固定,則所需O的質量比為2:3。
(6) N、O可形成NO、NO2、N2O和N2O5等物質, E.
原子說:1803年,(英)道耳吞,現代原子模型的雛型
(1) 原子是構成一切物質最基木粒子。原子不能再分割。
(2) 相同原子具有相同質量及化學性質。
(3) 不同種的原子,以簡單的整數比,結合形成化合物。
(4) 化合物分解所得的原子,與構成化合物之同種原子性質相同。
(5) 化學變化時,原子重新排列,原子的質量、種類、數目不變。(與核反應不符)
(6) 「原子說」可圓滿解釋「質量守恆定律」、「定比定律」、「倍比定律」,但不能解釋與分子有關的定律。 (二)
分子說及其基本定律 A.
氣體反應體積定律:1808年,(法)給呂薩克
(1) 同溫同壓下,氣體反應時反應物及生成物的氣體體積恆成簡單整數比。 B.
亞佛加厥定律:1811年,(義)亞佛加厥
(1) 同溫同壓下,同體積的一切氣體含有相同數目的分子 (但原子數不一定相同)。 C.
分子說:1811年,(義)亞佛加厥。
(1) 物質是由能夠單獨存在的分子構成。
(2) 分子是由原子所構成。
(3) 相同分子具有相同質量及化學性質。
(4) 物質與構成的分子具有相同性質。(決定氣體化學性質的粒子就是分子)
(5) 「亞佛加厥定律」又名「分子說」,可圓滿解釋 「氣體反應體積定律」。 (三)
原子質量單位: A.
定義:為原子的質量單位(atomic mass unit,記為amu) B.
標準:
(1) 1莫耳12C原子的質量有12克。
(2) 1個碳原子12C的質量記為12amu。
(3) 1amu=1個12C原子質量的1/12。 C.
關係換算:
(1)
(2) 在微觀世界中,以amu作為原子質量的單位;
D.
應用:
(1) 10個12C原子的質量為12X10=120(amu)
(2) 硫的原子量=32amu,則20個硫原子的質量=20x32=640(amu) 例1. 已知鋁的原子量為27amu,則50個鋁原子的質量為若干? [解析]:1個鋁原子的質量為27amu 50個鋁原子的質量為27X50=1350(amu)。 (四)
原子量: A.
定義:
(1) 原子的質量極小,無法直接測量。
(2) 原子的質量,採用相對質量表示法。 B.
標準:
(1) 最早期:道耳頓以最輕的原子H=1,作為原子量的標準。
(2) 1905年,國際原子量委員會決定採用自然界存在的氧,將其原子量訂為16。
(3) 1961年,國際純化學暨應用化學聯合會(IUPAC)決定以12C=12.0000,作為原子量的標準,決定出其他原子的相對原子量。 C.
單位:amu,原子質量單位 D.
實例:得A原子與12C原子的質量比為x:1,若A的原子量為Mamu, E.
原子量不一定是整數,因為原子量是根據某原子質量與12C原子質量的比而得。 F.
原子量的表示法:
(1) 32S的原子量=32。
(2) 1個32S原子的質量=32 amu。 (3) 1莫耳32S原子的實際質量為32克。 例2. 若測得同數目的12C原子與16O原子的質量比為3:4,則16O的原子量為若干? [解析]: 例3. 已知相同數目的S原子、O原子和12C原子的質量比為4:8:3,則: [解析]:(1) S:O:12C=4:8:3=x:y:12 x=16 (amu), y=32 (amu) (五)
平均原子量: G.
意義:
(4) 因大部分的元素皆有同位素存在,故週期表呈現的原子量為各同位素的加權平均。
(5) 平均原子量等於各同位素原子量(M1、M2……)與其百分含量(x1、x2……)之乘積的總和。 H.
關係式: 例4. 自然界中的10B與11B的含量比為1:4,則B的平均原子量為_______amu。 [解析]:(1) 10B佔全部的1/5,而11B則佔全部的4/5; 例5. 自然界中氯有35Cl(原子量=35.0)、37Cl(原子量=37.0),其天然存在自然界的比例分別為75%、25%,則氯的平均原子量=_______。 [解析]:35x0.75+37x0.25=35.5(amu)。 例6. 化合物AB中,A所佔的重量百分率為40%,同時發現A有同位素20A(佔70%)、22A(佔30%),而B也有2種同位素30B及32B,則30B所佔的比率為_______%。 [解析]:A的平均原子量=20x0.7+220.3=20.6 (amu) (六)
分子量: A.
定義:分子中所含原子質量的總和,稱為分子量。 B.
莫耳質量:
(1) 1莫耳(mol)分子的實際質量,即6.02x1023個分子的質量,即為克分子量,或稱為莫耳質量。 C.
單位:
(1) 分子量可表示為1莫耳分子的質量,寫成g/mol。
(2) 1個分子的質量,可以amu表示。
(3) 乙醇(C2H5OH)的分子量為12x2+6x1+16x1=24+6+16=46 D.
分子量的求法(蒸氣密度法):
(1) 利用某特定狀況下的氣體密度求得分子量。
(2) 標準狀況(STP,1atm,0℃)時,任何氣體的體積皆為22.4公升。
(3) 氣體分子量M=STP下的蒸氣密度 x
STP下的莫耳體積(22.4L) 例7. 氮的原子量為14.0,則: 例8. 已知一個O2分子量為32,則一個O2分子的質量為若干? [解析]:1個O2分子的質量=32amu,且1amu=1.67x10-24克。 (七)
莫耳: A.
意義:
(1) 為計算原子或分子常用的單位,用以方便表示數目極大的分子或原子。
(2) 12克的12C原子中所含的原子總數,即為1莫耳。 B.
代號:以mol表示。 C.
數值:
(1) 1莫耳(mol)的個數約為6.02x1023個,一般將此數值稱為亞佛加厥數(NA)。
(2) 6.02x1023個原子,稱為1莫耳,但此數值僅為一個概數,不是恰巧等於。 D.
換算關係: E.
1 莫耳(mol)CO2分子有6.02x1023
個CO2分子。 (八)
莫耳質量: A.
意義:1莫耳物質所具有的質量,即稱為該物質的莫耳質量。 B.
單位:公克。 C.
數值:依物質的是化學式,求得原子量的總和。 D.
原子的莫耳質量: E.
分子的莫耳質量:(S=32,Ca=40)
(1) 硫酸分子式為H2SO4,則硫酸的莫耳質量=1x2+32x1+16x4=98克。
(2) 氫氧化鈣的化學式為Ca(OH)2,則氫氧化鈣的莫耳質量=40+16x2+1x2=74克。
(3) 葡萄糖的化學式為C6H12O6,則葡萄糖的莫耳質量=12x6+1x12+16x6=180克。
(4) F.
莫耳與其他物理量的換算關係:
(1) 將氣體體積換算成莫耳:
(2) |
|||||||||||||||||||||||||
|
(
)1. 下列何者可說明倍比定律? 【答案】:【D】 【解析】:(A)氧O2,臭氧O3為同素異形體,相同的元素,但是為不同的結構。 (
)2. 下列哪一組的化合物,其組成不能以倍比定律說明? 【答案】:【A】 【解析】:倍比定律指兩種元素組成不同的化合物,若固定其中一元素的質量,則另一元素的質量成簡單整數比。 (
)3. 若化合物A2B的重量百分比組成為60%A與40%B,則化合物AB2的重量百分組成,與下列何組重量百分組成最接近? 【答案】:【A】 【解析】:已知化合物A2B質量比為60%和40%,假設A的質量佔60克,則B的質量佔40克。 (
)4. 已知亞佛加厥數為6.02X1023,下列哪一項所含氫的原子數最多? 【答案】:【D】 【解析】:(A)3.01X1023個氫分子的氫原子= |
|||||||||||||||||||||||||
|
二、多選題: ( )1.
道耳頓的「原子說」可解釋哪些基本定律? 【答案】:【ABE】 【解析】:道耳頓原子說可以解釋(E)質量守恆定律、(B)倍比定律和(A)定比定律。 ( )2.
以今日的化學知識而言,下列道耳頓1802年所提出之「原子說」,何者必須修正? 【答案】:【AD】 【解析】:道耳頓的原子說以不合時宜的部分為: |
|||||||||||||||||||||||||
|
三、非選題 1. 下列五種定律,確立了原子與分子之概念,試回答下列各小題: (1) 【(A)質量守恆定律、(B)氣體反應體定律、(C)亞佛加厥假說、(D)倍比定律】為依據具體「實驗」而提出的學說。 (2) 【(E)定比定律】為依據「假設」而提出。 (3) 道耳頓提出之「原子說」,可說明的定律為【(A)質量守恆定律】、【(D)倍比定律】、【(E)定比定律】。 (4) 為了解釋【(B)氣體反應體積定律】定律,因而提出【C亞佛加厥假說】,因而建立了分子概念。 2. 按定比定律完成下列圖表,試寫出下列空格的答案:(原子量:Si=28) 【解析】:1克的H和8克的O組成(A),H:O= 3. 同溫同壓下,CO和CO2具有同數目的原子,則下列比值關係分別為若干?(均為CO:CO2) (1) 莫耳數比=【3:2】; (2) 分子量比=【7:11】; (3) 重量比=【21:22】; (4) 體積比=【3:2】。 【解析】:一個CO有2個原子,一個CO2有3個原子,當兩者的原子數目相同時, 4. A、B、C三種化合物均含有Q元素,經分析結果如附表,試求Q元素之原子量最大為__________。 【解答】:19 【解析】:化合物A中Q的質量=152x50%=152x0.5=76克。 5. 已知鈉的原子量為23.0,則: 【解答】:(1) 【解析】:(1) 鈉的原子量為23,表示1個鈉原子的質量為23 amu; 6. 已知甲烷分子式為 【解答】:(1) 【解析】:(1) 甲烷分子式為CH4,分子量為12+1x4~=16;1莫耳的CH4有16克; 7. 請依定比定律寫出如圖代號之答案:(原子量:C (1) (2) B的化學式為__________。 (3) C的化學式為__________。 (4) x的值為__________。 (5) y的值為__________。 【解答】:(1)H2O (2)CH4 (3)Al2O3 (4)3 (5)9 【解析】:(1) 化合物A由1克的H和8克的O相結成, 8. 在化學發展的過程中,有許多科學家貢獻良多,試由下列選項中選出正確者,並回答相關問題:(以下科學家請以代號作答)
(1)
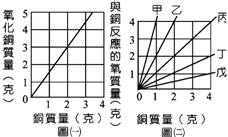
由物質的燃燒實驗中,發現氧的存在之科學家為__________,其並利用天平稱重,發現物質發生化學變化時,反應前後物質總重並未改變,而提出__________定律。 (2) 提出原子學說之科學家為__________,他另外認為兩種由相同元素所形成之不同化合物,固定其一質量,則另一質量必成簡單整數比,而提出__________定律。 (3) 發現於同溫、同壓下,氣體物質互相反應時,反應物間之體積將成一簡單整數比之科學家為__________,但此定律不能以原子學說解釋,故有另一科學家__________,提出決定物種化學性質之基本粒子應為__________,以修正原子學說。 【解答】:(1)己(拉瓦節);質量守恆 (2)丙(道耳頓);倍比 (3)戊(給鋁薩克);甲(亞佛加厥);分子 9. (1) 當5克的銅在空氣完全氧化時,生成氧化銅__________克。 (2) 圖(二)中甲∼戊五條直線中,何者可代表「銅」與「氧」相化合的質量關係?__________。 (3) 另取4克的銅與4克的氧,置於密閉容器內使其充分反應,可得氧化銅__________克,且剩餘__________(填銅或氧)__________克。 【解答】:(1)7.5 (2)丁 (3)6;氧;2 【解析】:(1) 由圖(一),2克的銅反應,可以產生3這的氧化銅; 10. 已知 【解答】:20 【解析】:已知 |
|||||||||||||||||||||||||
|
|