|
____1. 血紅素含有0.335%的Fe,它可能的最低分子量為何?
(A)300 (B)1700 (C)3000 (D)17000。(Fe = 55.8)
【答案】:(D)
【解析】:一個血紅素分子至少含一個鐵原子Fe,因此
血紅素的分子莫耳數:鐵原子的莫耳數=1:1
100克的血紅素含鐵原子0.335克 [ 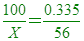
[ 0.335X=5600 [ X=16716
____2. 反應aM + bN → cR,已知分子量M = 30,N = 60,欲生成100克R需N幾克?
(A)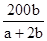 (B) (B)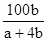 (C) (C)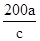 (D) (D)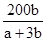 。 。
【答案】:(A)
【解析】:方程式的係數比=莫耳數比 [ a莫耳的M和b莫耳的N,反應產生c莫耳的R
依質量守恆關係,反應物消耗的總質量=生成物產生的總質量,假設R的分子量為R
ax30+bx60=cxR R的分子量為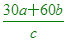
係數比=莫耳數比 ,假設需要Y克的N [ 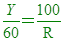 [ YR=6000 [ YR=6000
[ 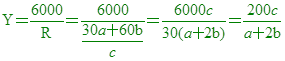
____3. 已知甲、乙兩種氣體,各重1.64克及0.5克。在同溫同壓時,甲氣體之體積為乙氣體的2倍,若知乙氣體的分子量為28,則下列分子何者可能為甲氣體?
(A)NO2 (B)N2O (C)N2O4 (D)N2O5。(分子量:N = 14,O = 16)
【答案】:(A)
【解析】:甲氣體之體積為乙氣體的2倍,所以甲莫耳數為乙的2倍,體積比=莫耳數比
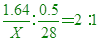 [ [ 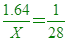 [X=28x1.64=45.92≒46 [X=28x1.64=45.92≒46
分子量:(A)NO2=14+16x2=46
(B)N2O=14x2+16=44
(C)N2O4=14x2+16x4=92
(D)N2O5=14x2+16x5=108
____4. 已知3A + 2B → 2C,A、B、C表不同分子;若A、C分子量分別為24及72,則B的分子量為:
(A)12 (B)36 (C)40 (D)48。
【答案】:(B)
【解析】:3x24+2xB=2x72 [ 2B=144-72=72 [ B=36
____5. 某一直鏈烴其蒸氣密度約為同溫、同壓下氧密度的2.25倍,此烴為:
(A)丙烷 (B)丁烯 (C)丁炔 (D)戊烷。
【答案】:(D)
【解析】:假設兩氣體為同體積,則密度=質量÷體積,體積相同時,密度比=質量比
所以烴類蒸氣的質量為氧氣質量的2.25倍,而兩氣體為同溫同壓,再同體積時,會有相同莫耳數
假設氧氣質量1克時,烴類蒸氣質量X克,同體積時,同莫耳數
[ 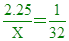 [ X=72 [ X=72
(A)丙烷=C3H8=12x3+1x8=44 (B)丁烯=C4H8=12x4+1x8=56
(C)丁炔=C4H6=12x4+1x6=54 (D)戊烷=C5H12=12x5+1x12=72。
____6. 若mBx + nAyBz
→ pAuBv,則v =
(A)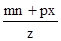 (B) (B)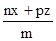 (C) (C)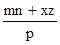 (D) (D)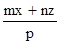 。 。
【答案】:(D)
【解析】:.方程式平衡時,兩邊的原子個數會相等,
B原子相等: mx+nz=pv [ 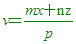
____7. 甲乙二化合物之組成元素均為A與B,其重量百分組成分別為:甲含40% A和60% B,乙含25% A和75% B,則依倍比定律,甲、乙中B元素重量比為何?
(A)1:2 (B)2:3 (C)1:3 (D)3:4 (E)4:5。
【答案】:(A)
【解析】: 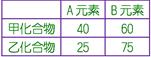 [ [ 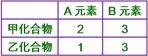 [ [ 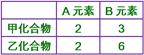
當A元素質量相同時,B元素的質量比=3:6=1:2
____8. 某化合物A2B3
15.0克中含有B
4.5克,另一含A、B之化合物中,B占重量16%,其化學式可能為:
(A)A3B2 (B)AB (C)A2B (D)AB2。
【答案】:(A)
【解析】: 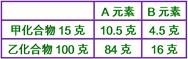 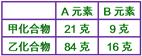 [ [ 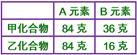
假設乙化合物為A2Bx,則A相同,B質量比 3:x=36:16=9:4
9x=12
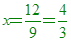 因此B的化學式為 因此B的化學式為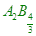 [ A6B4 [ A3B2 [ A6B4 [ A3B2
____9. 碳和一氧化碳燃燒分別可生成化合物I和II。其中,4.4克的化合物I含有1.2克Y;Ⅱ之組成中含有3/11的Y,若兩化合物的沸點亦相同。則此結果應可說明下列何者?
(A)倍比定律 (B)定比定律 (C)質量守恆定律 (D)氣體化合體積定律
(E)兩者的化學式分別為XY、XY3。
【答案】:(B)
【解析】:4.4克的化合物I含有1.2克Y;因此Y佔 1.2/4.4=3/11
化合物Ⅱ之組成中含有3/11的Y,因此兩者Y的比例相同,同時發現兩者的沸點也相同,因此兩者可能是同一物質,這是根據定比定律。
同一化合物,不論其來源或製造方法,其組成元素的質量比為定值。
____10. 已知化合物Ⅰ及Ⅱ均僅含碳及氫,分析化合物Ⅰ32克知含氫8克,化合物Ⅱ 30克含碳24克,若化合物Ⅰ之分子式為CH4,則下列化學式中,何者可能是化合物Ⅱ的分子式?
(A) C2H2 (B)
C2H6 (C) C2H3 (D)
C3H4 (E) C3H8。
【答案】:(B)
【解析】: 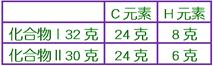 碳質量相同,H質量比=8:6=4:3 碳質量相同,H質量比=8:6=4:3
因此化合物Ⅱ的化學式為CH3,無CH3之物質,可能為C2H6。
____11. 下列哪一項不是道耳頓原子說的內容?
(A)原子是組成物質的最小粒子,無法再分割 (B)原子以簡單整數比結合成化合物
(C)不同元素的原子其質量與性質皆不相同 (D)一切物質都由原子組成,原子是最基本的粒子
(E)當原子與原子形成化合物時牽涉到電子的得失。
【答案】:(E)
【解析】:1807年道耳吞提出原子說時,尚未發現質子、中子、電子的存在,因此化學反應和電子的轉移概念無關。
____12. 有甲、乙兩種氣體,各重1.64 g及0.5 g。在同溫同壓時,甲氣體之體積為乙氣體之2倍,若知乙氣體之分子量為28,則下列分子何者可能為甲氣體?(N=14)
(A)NO2 (B)N2O (C)N2O4 (D)N2O5。
【答案】:(A)
【解析】:同溫同壓下,氣體的體積比=莫耳數比=甲:乙=2:1 [ 莫耳數比=2:1 [ 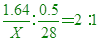 [ [ 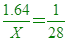 [X=28x1.64=45.92≒46 [X=28x1.64=45.92≒46
分子量:(A)NO2=14+16x2=46 (B)N2O=14x2+16=44
(C)N2O4=14x2+16x4=92
(D)N2O5=14x2+16x5=108
____13. 已知在100°C、1atm下,每升A氣體的質量為1.05克。每升B氣體的質量為0.066克。若B氣體的分子量為2,則A氣體之分子量最接近
(A)8 (B)16 (C)32 (D)48。
【答案】:(C)
【解析】:100°C、1atm下,體積都1公升 [同溫同壓同體積的氣體[ 同分子數 [ 同莫耳數
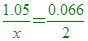 [ x=31.8≒32 [ x=31.8≒32
____14. 氣體甲與氣體乙相化合成安定的丙氣體。由實驗知,相同狀況下,其反應體積比甲:乙:丙=2:4:3,且甲、乙均為元素單質,丙為甲、乙兩元素之化合物。下列敘述何者正確?
(A)一分子甲必含偶數個原子 (B)一分子乙必含偶數個原子
(C)一分子丙必含偶數個原子 (D)甲、乙可能為雙原子分子。
【答案】:(C)
【解析】:反應體積比甲:乙:丙=2:4:3 [ 2甲+4乙→3丙
甲乙可能為奇數個原子或偶數個原子,但丙必為偶數個原子,否則方程式無法平衡。
____15. 二體積的A氣體與一體積的B氣體化合成二體積的C氣體,若B的分子中含X、Y兩種原子,則下列何者不能表示B可能的化學式?
(A)X2Y4 (B)X3Y3 (C)X4Y2 (D)X6Y2。
【答案】:(B)
【解析】:2A+B→2C,A可能為偶數或奇數個X或Y,C可能為偶數或奇數個X或Y;
但是B必為偶數個原子X或Y,因此B不可能為X3Y3。
____16. 若化合物A2B之重量百分組成為60% A與40% B;則化合物AB2之重量百分組成,與下列何組重量百分組成最接近?
(A)27% A與73% B (B)33% A與67% B (C)40% A與60% B (D)50% A與50% B。
【答案】:(A)
【解析】:假設2個A質量為60,則1個A的質量為30;1個B質量為40,則2個B質量為80;
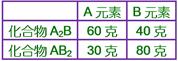 因此AB2中,A佔 因此AB2中,A佔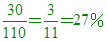 ,B佔 ,B佔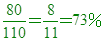
____17. 若化合物AB4中,A元素的重量成分組成為80%,則50克的A3B2中含有A元素多少克?
(A)12 (B)24 (C)36 (D)48 克。
【答案】:(D)
【解析】: 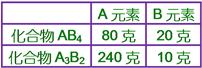 A3B2中,A佔 A3B2中,A佔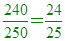 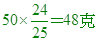
____18. 下列哪一敘述不完全正確?
(A)分子中所含原子數必為整數 (B)不同元素之原子,其性質亦不同 (C)原子種類相同、數目亦相同,所形成之物質不一定是同一物質 (D)同元素之原子,其質量必相同。
【答案】:(D)
【解析】:同元素的原子,由於可能有同位素存在,因此質量不一定會相等。
____19. 維他命C的分子量176,約含重4.5%的氫,則1分子的維他命C中含幾個氫原子?
(A)8 (B)6 (C)4 (D)2。
【答案】:(A)
【解析】:100克維他命C分子中含H原子4.5克,因此176克維他命C分子中含H原子質量x,
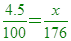 x=7.92≒8,約為8個H原子 x=7.92≒8,約為8個H原子
____20. 在200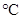 、0.3 atm時有 、0.3 atm時有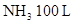 、 、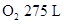 ,混合後引燃,進行下列反應: ,混合後引燃,進行下列反應: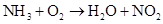 (未平衡),若反應的溫度及壓力均保持不變,下列何者正確? (未平衡),若反應的溫度及壓力均保持不變,下列何者正確?
(A)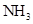 尚未耗盡 (B)反應後有300 L的 尚未耗盡 (B)反應後有300 L的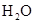 生成 生成
(C)反應後混合氣體共250 L (D)反應後混合氣體共350
L。
【答案】:(D)
【解析】: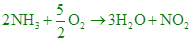 NH3和O2消耗體積比=2:5/2=4:5 NH3和O2消耗體積比=2:5/2=4:5
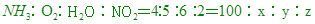
x=125L NH3消耗完畢,O2會剩餘275-125=150L
y=150L,產生水蒸氣(200℃)150L, z=50L,產生NO2氣體50L。
反應後氣體的總體積=150+50+150=350L(含剩餘的氧氣O2=150L)
____21. 二氧化碳中的原子總數為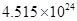 個時,其質量為若干克? 個時,其質量為若干克?
(A)44 (B)88 (C)110 (D)330 (E)440。
【答案】:(C)
【解析】:CO2一個分子有3個原子,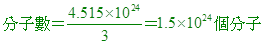
分子莫耳數=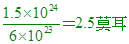 [ CO2的分子量=44 [總質量=44x2.5=110克。 [ CO2的分子量=44 [總質量=44x2.5=110克。
____22. 已知硼原子的質量為10.81 amu,硼原子乃由原子量為10.01 amu的10B和原子量為11.01
amu的11B兩種同位素所組成,則10B所占硼原子的百分率為下列何者?
(A)20% (B)30% (C)70% (D)80%。【90日大】
【答案】:(A)
【解析】:假設10.01的10B佔x,則11.01的11B佔(1-x)
10.01x+11.01(1-x)=10-.81 11.01-x=10.81 x=0.2=20%
____23. 同溫、同壓下,若20毫升的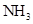 分子含n個原子,則n個原子的 分子含n個原子,則n個原子的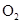 需多少毫升? 需多少毫升?
(A)10 (B)20 (C)40 (D)60。
【答案】:(C)
【解析】:同溫同壓下的氣體,體積比=分子數比=莫耳數比
NH3一個分子有4個原子, [ n個原子含n/4個分子
O2有n個原子,所以有n/2個分子, 分子數比=體積比
NH3:O2=n/4:n/2=1:2=20毫升:x毫升 x=40毫升
____24. 某化合物1分子中含有1個鐵原子,4個X原子及其他原子,若Fe及X之重量百分組成均為6.27%,則1個X原子的質量為若干?(Fe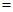 56) 56)
(A)39 (B)14 (C)24 (D)112 (E)32 amu。
【答案】:(B)
【解析】:Fe原子:X原子=1:4 [ 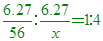 [ [ 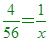 [ x=14 [ x=14
____25. 某金屬之原子量為w,若取該三價金屬之氧化物x克,將其完全還原後,可得y克金屬。試問該金屬的原子量w可以用下列的哪一式子表示?
(A)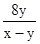 (B) (B)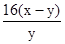 (C) (C)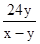 (D) (D)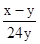 (E) (E)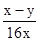 。 。
【答案】:(C)
【解析】:三價金屬之氧化物假設化學式為A2O3,則分子量為2w+16x3=2w+48
其中x克的氧化物中含A原子=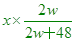 克 克
反應後還原出A原子質量y=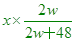 [ 2wx=2wy+48y [ 2wx=2wy+48y
2wx-2wy=48y wx-wy=24y [ w(x-y)=24y [ 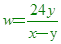
____26. 下列哪一組物質,其組成不能以倍比定律說明?
(A)氧及臭氧 (B)一氧化碳及二氧化碳 (C)水與過氧化氫 (D)一氧化氮及二氧化氮。
【答案】:(A)
【解析】:氧(O2)及臭氧(O3)為元素,不是化合物,不遵守倍比定律。
倍比定律為『兩種元素組成不同的化合物,若固定其中一元素的質量,則另一質量成簡單的整數比。』
____27. 下列各數量的物質,何者含有最多的原子總數?
(A)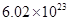 個 個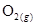 (B)0 (B)0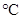 、1 atm時,22.4 L的 、1 atm時,22.4 L的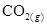 (C)30 amu (C)30 amu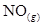 (D)16 g (D)16 g 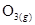 。(0 。(0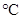 、1 atm時,1 mol氣體 、1 atm時,1 mol氣體 22.4 L)(原子量:C 22.4 L)(原子量:C 12,N 12,N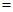 14,O 14,O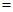 16) 16)
【答案】:(B)
【解析】:6.02x1023個O2分子含原子數=6.02x1023 x2=1.2x1024個O原子
0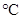 、1 atm,22.4升的CO2為1莫耳的氣體,含原子數=6x1023x3=1.8x1024個原子 、1 atm,22.4升的CO2為1莫耳的氣體,含原子數=6x1023x3=1.8x1024個原子
NO的分子量=14+16=30,1個NO分子質量為30amu
16克的O3=16/48=1/3莫耳分子,含原子=1/3x3=1莫耳原子=6x1023個原子
含原子數最多依序為(B)[(A)[(D)[(C)。
____28. 某化合物含r個結晶水,該水合物3.2克加熱完全除去結晶水後,重量變為1.4克,則該水合物之式量為下列何者?
(A)14r (B)32r (C)50r (D)64r。
【答案】:(B)
【解析】:3.2-1.4=1.8克 1個水合分子含r個水,水分子量18;
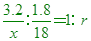 [ [  [ x=32r [ x=32r
|