|
____1.
取16.02克的PbCO3置於真空中加熱,產生一種鉛的氧化物重為13.70克。則此氧化物的化學式為何?
(A)PbO (B)PbO2 (C)Pb2O3 (D)Pb3O4。(Pb=207)
【答案】:(D)
【解析】:PbCO3分子量=207+12+16x3=267 其中鉛Pb佔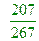
Pb含量=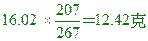 反應後的氧化物中亦含有Pb12.42克 反應後的氧化物中亦含有Pb12.42克
氧含量=13.70-12.42=1.28克 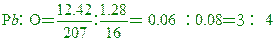
因此化學式為Pb3O4
____2.
甲、乙兩化合物均由A、B兩元素組成,其重量百分組成甲為20% A和80% B,乙為25% A和75% B,已知甲的化學式為AB2,則乙的化學式為何?
(A)AB3 (B)A3B2 (C)A2B3 (D)A3B。
【答案】:(C)
【解析】: 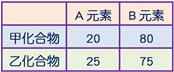 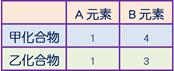
甲的化學式為AB2
則假設乙的化學式為 ABm,2:m=4:3 4m=6 m=3/2
乙化學式為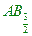 [ A2B3 [ A2B3
____3.
同溫、同壓下,同體積的甲、乙兩種氣體的質量比為17:14,乙氣體是CO,則甲氣體可能是:
(A)Cl2 (B)HCl (C)NH3 (D)H2S。(原子量:S = 32,N = 14,Cl = 35.5)
【答案】:(D)
【解析】:同溫、同壓下,同體積的甲、乙兩種氣體會有相同的莫耳數
假設甲質量17克,則乙質量14克, 乙氣體分子量CO=12+16=28
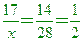 x=34 H2S的分子量=1x2+32=34
x=34 H2S的分子量=1x2+32=34
____4.
C2H6、C6H6及C3H6固定碳的質量,氫的質量比為:
(A)1:1:1 (B)2:1:3 (C)2:6:3 (D)3:1:2。
【答案】:(D)
【解析】:將碳的數目固定,則成為 C6H18、C6H6、C6H12,
H的數目比=18:6:12=3:1:2
____5.
某氣體在27°C、1大氣壓下,0.6公升重0.7克,氧於同溫同壓下1.2公升重1.6克,則此氣體可能是:
(A)NO (B)CO (C)NO2 (D)CO2。(原子量:C = 12,N = 14,O = 16)
【答案】:(B)
【解析】:同溫、同壓下,體積比=莫耳數比,假設甲氣體的分子量為X,
0.6:1.2=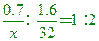
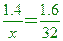 X=28 CO=12+16=28 X=28 CO=12+16=28
____6.
聚乙烯是一種塑膠,俗稱PE,它是由乙烯(C2H4)聚合而成,下列關於乙烯元素分析的敘述何者正確?
(A)1莫耳的乙烯有六個原子 (B)質量比C:H = 1:6 (C)某物質經分析,其C與H的原子數比為1:2,則此物質必為乙烯 (D)無論氣態與液態,其C與H的原子數比皆相同。(原子量:C = 12,H = 1)
【答案】:(D)
【解析】:乙烯的化學式=C2H4,一個乙烯分子含有2個C、4個H,有6個原子,
(A)一莫耳分子有6莫耳的原子。
(B)C:H的質量比=12x2:1x4=24:4=6:1
(C)C:H=1:2,可能為C2H4、C3H6等物質,不一定只有乙烯C2H4。
(D)乙烯中的原子個數C:H必為1:2,和狀態無關。
____7.
下列氮的氧化物,何者氧的重量百分率為70%?
(A)NO (B)N2O (C)N2O4 (D)N2O5。(原子量:N = 14,O = 16)
【答案】:(C)
【解析】:(A)NO=14+16=30 O佔16/30=53.3%
(B)N2O=28+16=44 O佔16/44=36.4%
(C)N2O4=28+64=92 O佔64/92=69.6%,約70%
(D)N2O5=28+80=108 O佔80/108=74%
____8.
水的分子式為H2O,甲生取2克的氫氣與20克的氧氣使之完全反應,將所生成的水稱重得18克,下列關於此實驗的敘述何者正確?
(A)此實驗足以證明化學反應並不遵守質量守恆定律 (B)此反應仍遵守質量守恆定律,只是甲生並未考慮未反應的氣體質量 (C)此反應仍遵守質量守恆定律,只是甲生並未考慮反應前後溫度的差異 (D)利用原子量可推測氧氣雖然已完全反應,但氫氣仍有剩餘。
【答案】:(B)
【解析】:2克的氫氣(H2)只能和16克的氧氣(O2)反應,產生18克的水,仍遵守質量守恆定律
氣體反應質量和溫度狀態無關。
此反應中氧氣過量,僅消耗16克O2,還剩餘20-16=4克的氧氣O2,氫氣則用完。
____9.
某醯胺類的有機物經分析其原子數比為C:H:O:N = 2:5:1:1,88.5克的此醯胺類有機物中,含N原子重量為若干克?
(A)14克 (B)21克 (C)28克 (D)35克。
【答案】:(B)
【解析】:化合物的簡式為 C2H5ON,式量=12x2+1x5+16+14=59,其中含N=14
88.5x14/59=21克
____10. 甲、乙、丙、丁四種碳氫化合物,分析其組成元素的質量比,得結果如下表,則甲、乙、丙、丁中是否可能有相同的化合物?這是根據何種化學定律所做之推論? 甲、乙、丙、丁四種碳氫化合物,分析其組成元素的質量比,得結果如下表,則甲、乙、丙、丁中是否可能有相同的化合物?這是根據何種化學定律所做之推論?
(A)是,定比定律 (B)是,倍比定律 (C)否,定比定律 (D)否,倍比定律。
【答案】:(A)
【解析】:乙和丁的化合物質量比相同,可能同一物質。
36:6=12:2=24:4 同一物質質量比必定相同,質量比相同則可能是同一物質。
____11..已知甲、乙、丙均為氣體,且同溫、同壓下,2 體積甲和 1 體積乙化合成 2 體積之丙。若甲之化學式為 A2,則乙之化學式可能為下列何者?
(A) A2B (B) AB2 (C) A2B2 (D) A2B3。
【答案】:(C)
【解析】:2 體積甲和 1 體積乙化合成 2 體積之丙。反應式為 2甲+1乙→2丙
甲中的A為偶數,丙亦為偶數,則乙中含A必為偶數
甲中無B元素,因此乙中的B和丙中的B原子數目同,丙中的B元素必為偶數,
因此乙中的B元素必為偶數。因此只能選擇A2B2。
____12.氮與氧兩元素可形成下列三種化合物 NO、N2O3、N2O5,則與相同質量氮元素化合所需氧元素的質量比為何?
(A) 1:3:5 (B) 2:3:5 (C) 5:3:2 (D) 15:10:6。(以 NO:N2O3:N2O5 表之)
【答案】:(B)
【解析】:化合物 NO、N2O3、N2O5,若N的數目相同,則成為N2O2、N2O3、N2O5,
則O的數目比為2:3:5。
____13.均由 A、B 兩元素所組成的甲、乙兩化合物,經元素分析得知 5.2 克甲中含 A 元素 4.8 克,4.4 克乙中含 A 元素 3.6 克;已知甲的化學式為 AB,則乙的化學式為何?
(A) AB2 (B) A2B3 (C) A2B5 (D) A3B8。
【答案】:(D)
【解析】:
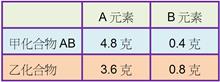 
1:m=9.6:3.6 9.6m=3.6 m=3.6/9.6=3/8
所以乙化合物的化學式為A3/8B [ A3B8
____14.燃燒 0.25 克的 H2,可得水 2.25 克;另以過量的 H2 還原 1.592 克的氧化銅,可得銅 1.272 克及水若干克?
(A) 0.25 (B) 0.32 (C) 0.36 (D) 0.72。
【答案】:(C)
【解析】:水中含O=2.25-0.25=2.00克 [ 2.25克的水中含O元素 2.00克
1.592克-1.272克=0.32克O [ 氧化銅中的O元素和H反應生成水H2O
O元素質量:水分子質量=2.00:2.25=0.32:X [ X=0.36克
____15.將氣體NO與O2混合,即反應生成NO2,若最初混合體積為100 mL,當完全反應後NO耗盡,同溫、同壓下,總體積為75 mL,求最初的NO體積為若干mL?
(A) 12.5 (B) 25 (C) 37.5 (D) 50 (E) 62.5。
【答案】:(D)
【解析】:NO+O2→NO2 將方程式平衡 [ 2NO+O2→2NO2
氣體反應的細數比=分子數比=莫耳數比=氣體的體積比
反應前共消耗2V體積的NO及1V體積O2,反應後產生2V體積的NO2,
因此反應後總體積減少2V+V-2V=V,體積共減少V
V=100-75=25mL,因此NO消耗完畢,共消耗了2V=25x2=50mL
____16.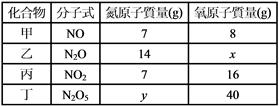 有四種氮的氧化物,其分子式與組成質量比如附表。若將此四個化合物中氮的質量固定,則氧的質量比為: 有四種氮的氧化物,其分子式與組成質量比如附表。若將此四個化合物中氮的質量固定,則氧的質量比為:
(A) 1:2:1:2 (B) 1:2:3:4 (C) 2:1:4:5 (D) 2:1:3:4
【答案】:(C)
【解析】:NO中的N與O分別為7與8,則N2O中含有2個N,N的質量應為7x2=14,O則維持8,因此x=8。
NO中的N與O分別為7與8,則N2O5中N應為7x2=14,O應為8x5=40,
因此N與O的質量比為14:40,所以y=14
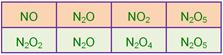
當N的數目相同時,O的數目比為2:1:4:5
____17.下列哪一種物質可用於說明定比定律?
(A)銅離子 (B)臭氧 (C)雙氧水 (D)氯化鉀。
【答案】:(D)
【解析】:定比定律可說明化合物中的組成元素,質量比為定值。
銅離子Cu2+不是化合物,臭氧是元素,不是化合物;
雙氧水是過氧化氫的水溶液不是化合物,只有氯化鉀為化合物。
____18.下列哪一項敘述符合道耳頓的原子理論?
(A)純水中H+的濃度為1.0×10-7 M (B)水是由H原子與O原子以2:1的比例所組成 (C)原子中含有質子、中子、電子 (D)發生核反應時,質量會有虧損的現象。
【答案】:(B)
【解析】:(A)道耳吞原子說僅說明原子不能再分割,未提及原子的帶電情形。
(B)道耳吞原子說能說明定比定律,化合物的組成原子其質量比為定值。
(C)道耳吞的原子說和質子、中子、電子的敘述無關,當時尚未發現質子、中子、電子等內部結構。
(D)核反應的質量不守恆,無法以道耳吞的原子說的內容解釋。
____19.下列何者與定比定律的敘述不符?
(A)化合物中各元素重量百分率為定值 (B)化合物中各元素的質量比為定值 (C)化合物的重量組成與該化合物的來源無關 (D)化合物各元素的質量成一簡單整數比。
【答案】:(D)
【解析】:化合物中的組成元素,其質量比為定值,但不一定為簡單的整數比。
____20.下列釩的氧化物中,何者含釩量最高?
(A) VO (B) VO2 (C) V2O3 (D) V2O5。(原子量:V=50.94)
【答案】:(A)
【解析】:令O的數目相同,則V最多者,所佔的比例最高。
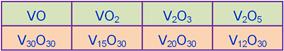
通分使O的數目相同後,VO中V的含量最多,因此VO中V所佔的比例最高。
____21.已知PbO2中Pb的重量百分比為86.62 %,則Pb3O4中含Pb的重量百分比約為若干?
(A) 80 % (B) 85 % (C) 90 % (D) 95 %。
【答案】:(C)
【解析】: 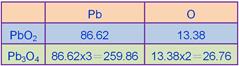
Pb所佔的比例=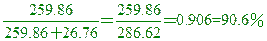
____22.在同溫、同壓時,下列敘述何者錯誤?
(A)氮1升和氧1升含有相同數目的分子 (B)氮1克和氧1克所占的體積相同 (C)氮28克和氧32克含有相同數目的分子 (D)氮28克和氧32克所占的體積相同。(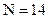 , ,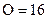 ) )
【答案】:(B)
【解析】:氮28克和氧32克皆為1莫耳的氣體,因此分子數相同,莫耳體積皆相同。
氮氣N2分子量28;氧氣O2分子量32,1克的N2含1/28莫耳的氮氣,及1/32莫耳的氧氣,因此質量雖然相等,但其莫耳數並不相等,分子數不相等。
____23.有關道耳頓的原子說,下列敘述何項錯誤?
(A)是一種假設 (B)原子以整個互相結合 (C)是現代物質科學的基礎 (D)相同原子的性質與質量並不一定相同。
【答案】:(D)
【解析】:道耳吞原子說的內容,認為相同的原子,必定含有相同的質量。
____24.金屬銅1克在空氣中加熱可得氧化銅1.25克,另取1克銅溶於硝酸中,加入NaOH,生成Cu(OH)2,然後再將Cu(OH)2加熱成為氧化銅,若誤差不計,亦產生1.25克的氧化銅。上述實驗可說明:
(A)質量守恆定律 (B)定比定律 (C)倍比定律 (D)道耳頓原子說。
【答案】:(B)
【解析】:Cu:CuO=1:1.25=4:5
不論來源或製造方法,同一物質的組成元素,其質量比恆為定值,稱為定比定律。
____25.哺乳動物的紅血球中,其血紅素含鐵的百分率為0.33%,若血紅素的分子量約為68000,則一分子的血紅素中含有多少個鐵原子?
(A)2 (B)3 (C)4 (D)5 。(Fe = 56)
【答案】:(C)
【解析】:100克的血紅素含鐵原子0.33克 [ 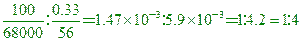
一個血紅素分子中約含有4個Fe原子
____26.某化合物由X 6.92克和碳0.584克所組成,設已知4個原子X能和1個原子碳結合,則X的原子量為:
(A)18.1 (B)35.5 (C)53.5 (D)71.0。
【答案】:(B)
【解析】:X:C=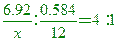 [ 0.195X=6.92 [ X=35.5 [ 0.195X=6.92 [ X=35.5
____27.在25℃、1atm下,4升的某氣體與5升的CO2的質量相等,則該氣體的分子量為何?
(A)35.2 (B)44.0 (C)55.0 (D)66.0。
【答案】:(C)
【解析】:同溫同壓下的氣體體積比=莫耳數比,所以體積比=4:5
兩氣體質量相等,假設質量m,則
CO2的分子量=12+16x2=44
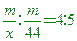 [ [ 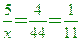 [ x=55 [ x=55
|








