|
( )1. 下列何組物質可說明倍比定律? 【答案】:(D) 【解析】:兩種元素由於有不同的化學價數,有不同的結合量,因此可以組成不同的化合物,違背比定律的主要原因。 ( )2. 已知 【答案】:(B) 【解析】:12克的碳產生44克的CO2,需要44-12=32克的氧, ( )3. 若自然界含有氖(Ne)的同位素分別為20Ne、22Ne,若Ne之平均原子量為 【答案】:(C) 【解析】:假設20Ne含量為P,則22Ne含量為1-P,則 ( )4. 某化合物A2B5(g)中,若質量比MA:MB=7:20,且A之原子量恰為14
amu/個,試問B的原子量為何? 【答案】:(C) 【解析】:A2B5的原子莫耳數A:B=2:5= ( )5. 已知葡萄糖的分子式為C6H12O6。試問1葡萄糖分子中碳、氫、氧的重量百分率依次應為 【答案】:(B) 【解析】:質量比=C:H:O=(12x6):(1x12):(16x6)=72:12:96 ( )6. 下列各選項中何者所含氧原子數最多? 【答案】:(D) 【解析】:(A)4.4
g的CO2含氧= ( )7. 下列各項定律中,何者無法以原子說解釋? 【答案】:(C) 【解析】:氣體反應體積定律為氣體分子反應的體積成簡單整數比,只能以分子說(亞佛加厥定律)解釋,無法以原子說解釋。 ( )8. 若乙烷(C2H6)中碳原子與氫原子數總和為9.632×1022個,則此乙烷氣體重為若干克?
【答案】:(C) 【解析】:乙烷(C2H6)中1個分子含2個C、6個H,共8個原子,因此 ( )9. 淨水處理時往往加入明礬(KAl(SO4)2.12H2O)作為凝聚劑。今取 【答案】:(E) 【解析】:明礬(KAl(SO4)2.12H2O)的分子量=[39+27+(32+16x4)x2]+12x(1x2+16)=258+216=474 ( )10. 某生進行氫氣燃燒生成水蒸氣的實驗,其反應式如下:2H2(g)+O2(g)®2H2O(g)若其欲得到 【答案】:(C) 【解析】:2H2(g)+O2(g)®2H2O(g),反應的體積比H2:O2:H2O=2:1:2,欲產生15公升的水蒸氣, |
|
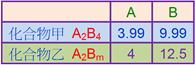
( )11. 某一氮氧化物中,氮與氧的重量比為7:16,試求此化合物中氮原子與氧原子之個數比? 【答案】:(E) 【解析】:N:O莫耳數比= ( )12. 1個葡萄糖(C6H12O6)重x amu;1個乙醇(C2H5OH)重y amu,試問x與y的大小關係? 【答案】:(A) 【解析】:C6H12O6的分子量=180,C2H5OH的分子量=46。 ( )13. 化合物甲由 【答案】:(A) 【解析】: ( )14. 等數目的 【答案】:(A) 【解析】:原子數目相等時,原子質量比=原子量比, [ C:X=12:X=4:9 ( )15. 氮的原子量為14,則100個氮原子的質量為何? 【答案】:(E) 【解析】:氮的原子量為14,1個N原子質量=14amu, ( )16. 若 【答案】:(D) 【解析】: ( )17. 某化合物由 【答案】:(B) 【解析】:化合物組成中含4個X和1個C,因此X:C莫耳數=4:1 ( )18. 某一硫氧化物中,硫與氧的重量比為1:1,已知硫的原子量為32
amu,氧的原子量為16
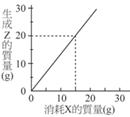
amu,則此化合物中硫原子與氧原子的個數比為 【答案】:(A) 【解析】:S:O質量=1:1 S:O莫耳數= ( )19. 【答案】:(A) 【解析】:由圖形可知,消耗15克的X,可產生20克的Z,因此Y消耗20-15=5克 ( )20. 氣體X和氣體Y相對分子量為11:8,氮氣和氣體X相對分子量比為7:11,則氣體Y可能為何? 【答案】:(A) 【解析】:N2分子量=14x2=28,因此N2:X氣分子量比=7:11=28:X X=44 |
|
( )21. 化合物甲、乙、丙均只由A、B兩元素組成,若A的質量相同時,B的質量比甲:乙:丙=
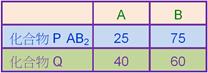
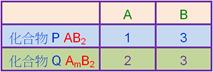
4:1:2;若B的質量相同時,A的質量比甲:乙:丙為何? 【答案】:(A) 【解析】:A有1克時,B的質量分別為4克、1克、2克; ( )22. 【答案】:(A) 【解析】:各物質含1克時,CH4的分子量=16,NH3=17,N2O=44,C3H6=42 ( )23. 取 【答案】:(B) 【解析】:NH3的分子量=14+1x3=17,1莫耳的分子有17克 ( )24. 假設在木星上發現一種超重的元素X;由於非常稀罕,僅能分離得3´1018個該原子,並稱得其重量只有1´10- 【答案】:(B) 【解析】: ( )25. 自然界中存有20Ne和22Ne兩種同位素,而氖的平均原子量為20.2,由此推知氖22Ne在自然界中含量約為 【答案】:(B) 【解析】:假設22Ne含量佔P,則20Ne含量佔(1-P) ( )26. 有甲、乙兩種氣體,分別重 【答案】:(C) 【解析】:同溫、同壓時,氣體的體積比=莫耳數比,N2分子量=14x2=28 ( )27. 某化合物1分子中含有1個鐵原子,4個X原子及其他原子,若Fe及X之重量百分組成均為6.27%,則1個X原子的質量為若干?(Fe=56) 【答案】:(B) 【解析】:分子中含1個Fe和4個X,因此原子莫耳數比Fe:X=1:4 ( )28. 若化合物A2B的重量百分組成為60%A與40%B,則化合物AB3的重量百分組成中A約占若干%? 【答案】:(A) 【解析】:A2B的重量百分組成為60%A與40%B,可視為 ( )29. 兩元素A和B反應,生成化合物P(質量:A占25%,B占75%)和Q(質量:A占40%,B占60%),若P的化學式為AB2,則下列何者為Q的化學式? 【答案】:(A) 【解析】:
( )30. 【答案】:(E) 【解析】: |
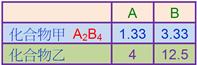 (
( (
(