|
|
|
(一)
氧化還原反應: A、
狹義: (1) 物質和氧化合的反應,稱為氧化;物質失去氧的反應,稱為還原。 (2) 物質失去氫的反應,稱為氧化;物質與氫化合的反應,稱為還原。 B、
廣義: (1) 物質失去電子的反應,稱為氧化;物質獲得電子的反應,稱為還原。 (2) 氧化數增加的反應,稱為氧化;氧化數減少的反應,稱為還原。 C、
實例: (1) 2Fe2O3+3C→4Fe+3CO2 a F2O3失去氧,被還原;C得到O,被氧化。 (2) Zn+Cu2+→Cu+Zn2+ a Zn失去2個電子,被氧化成Zn2+; (3) C+O2→CO2 a C的氧化數由0→+4,氧化數增加,C被氧化;O的氧化數由0→-2,氧化數減少,O被還原。 D、
常見不屬於氧化還原的反應: (1) 離子沉澱反應:NaCl+AgNO3→NaNO3+AgCl,各元素氧化數不變,不是氧化還原。 (2) 酸鹼中和反應:NaOH+HCl→NaCl+H2O,各元素氧化數不變,不是氧化還原。 E、
元素氧化活性的大小順序表: (二)
氧化還原反應: A、 氧化:活性大的元素,性質活潑,易和氧形成氧化物,性質變得比較安定。 B、 還原:活性小的元素,形成的氧化物性質安定,易和氧脫離,保持元素狀態。 C、
氧化還原反應: (1) 活性大的元素取代活性小的元素,使活性小的元素和氧脫離,稱為氧化還原反應。 (2) 此種反應方式必定氧化反應和還原反應同時存在。 (3) 活性小的元素不能取代活性大的元素。 (4) 容易失去電子的元素,容易發生氧化反應;可以還原容易得到電子的元素或是或合物。 (5) 產生氧化反應的物質稱為還原劑;產生還原反應的物質稱為氧化劑。
(6) 若A>B,則: A +
BOè B + AO D、
實例:
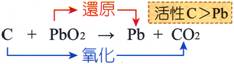
(1) 碳粉加入二氧化鉛混合後,以石棉紙包住,在火焰上加熱的實驗中,則: 反
應 方程式:C+2PbO2 à 2Pb +
CO2。 元素活性大小:C>Pb 氧化物的活性大小:CO2<PbO。 碳粉的顏色為
黑色; 二氧化鉛粉末的顏色為黃色。 氧
化 反 應:CàCO2 還原反應:PbOàPb。 氧 化
劑:PbO
還 原 劑:C。
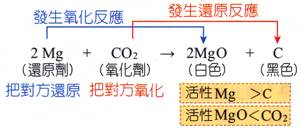
(2) 鎂帶在二氧化碳中燃燒,會產生白色的氧化鎂及黑色的碳粒子 反
應 方 程
式:2Mg+CO 氧 化 反 應:MgàMgO 還原反應:CO 還 原 劑:Mg 氧 化
劑:CO2。 Mg被CO2氧化成MgO;CO2被Mg還原成C。
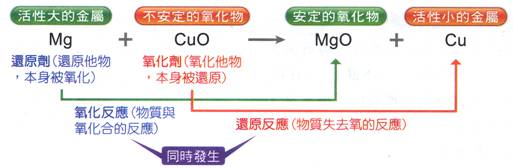
(3) 鎂帶和氧化銅反應產生白色的氧化鎂及赤紅色的金屬銅。 反
應 方 程
式:Mg+CuO
à Cu+MgO。 氧 化 反 應:MgàMgO 還原反應:CuOàCu。 還 原 劑:Mg
氧 化 劑:CuO。 Mg被CuO氧化成MgO;CuO被Mg還原成Cu。 此反應結束後,氧化銅的顏色由黑色轉變成紅色
|
|
(三)
氧化數: A、
氧化數的用途: (1) 有些反應不是典型的氧化還原反應,不容易判斷何項物質被氧化,或是被還原。 (2) 氧化數可以了解物質內的各項元素電子得失的變化,藉以判斷是否發生氧化反應或是還原反應。 (3) 元素的氧化數增加,表示該元素失去電子,因此發生氧化反應。 B、
規則: (1) 元素狀態的物質氧化數為零。 (2) 單原子離子的氧化數,即為該元素所帶的電荷數。 (3) 化合物中,氫的氧化數多為+1,但氫與金屬結合的氫化物,氧化數則為-1。 (4) 酸根離子的氧化數,即為該酸根中各元素的氧化數總和。 (5) 離子化合物溶於水可解離成陽離子與陰離子。 【例】:下列物質中畫線部分的元素的氧化數為若干? |
|
物質 |
K2CrO4 |
AgNO3 |
CuSO4 |
H2SO3 |
NH4NO3 |
|
氧化數 |
|
|
|
|
, |
|
物質 |
OF2 |
NaH |
NH4Cl |
NH3 |
K2Cr2O7 |
|
氧化數 |
|
|
|
|
|
|
物質 |
KMnO4 |
H2O2 |
(NH4)3PO4 |
NaClO3 |
Fe2O3 |
|
氧化數 |
|
|
, |
|
|
|
C、
日常生活中常見的氧化還原反應: (1) 光合作用: (2) 呼吸作用: (3) 水管暢通劑(通樂): (4) 雙氧水消毒: (5) 蘋果削皮後發生氧化反應: (6) 食物中的抗氧化劑: |
|
【題組】硫化菌所進行的反應是屬於氧化還原反應,假設其反應式如下: ( )1.
下列有關硫化菌所進行的反應,何者正確? ( )2.
針對上述反應式而言,下列哪一選項中的原子,其氧化數在反應前與反應後都相同? 【答案】:(1)B; (2)B 【解析】:(1) 8H2S+2O2+2CO2 → S8+2CH2O+6H2O 的反應式中: 【題組】汽車引擎會排放出 CO2、CO、NOx 及碳氫化合物等廢氣,造成空氣汙染。為減低此等廢氣的毒性,可加裝觸媒轉化器。由引擎排出的廢氣在進入大氣之前,先通過觸媒轉化器的第一部分,將 NO 反應成 NH3;之後再引進空氣與其混合,通過第二部分,觸媒轉化器可使廢氣中的 CO 及未完全燃燒的碳氫化合物在較低的溫度下,反應成 CO2 及 H2O,並使氨氣反應成 N2 及 H2O,使排出的廢氣中的碳氫化合物下降至 30 ppm、CO 下降至 0.1%。請依敘述,回答下列2題: ( )1.
觸媒轉化器並未處理下列哪一種氣體? ( )2.
觸媒轉化器的第一部分,將 NO 反應成 NH3 是屬於哪一種化學反應? 【答案】:(1)B; (2)B 【解析】:觸媒轉化器第一部分將NO→NH3,其中N的氧化數由+2a-3,可知發生還原反應。 ( )3.
美國芝加哥大學的研究人員實驗發現,蝦等甲殼類食物含有濃度較高的五價砷化合物。這種物質食入體內,對人體無毒害作用,但是在服用維生素 C 後,經化學反應會使原來無毒的五價砷(即砷酸酐,亦稱五氧化二砷,化學式為 As2O5),轉變為有毒的三價砷(即亞砷酸酐,亦稱三氧化二砷,化學式為 As2O3),這就是俗稱的砒霜。關於此化學反應的敘述,何者正確? 【答案】:(B) 【解析】:服用維生素C後, As2O5 → As2O3 ,因此五價砷會轉變成三價砷,可知砷被還原,而維生素C則被氧化,因此維生素C為還原劑,又稱為抗氧化劑。 ( )4.
氮化鋁(AlN)具有耐高溫、抗衝擊、導熱性好、……等優良性質,被廣泛應用於電子工業、陶瓷工業等領域。在一定的條件下,氮化鋁可通過如下的反應合成: 【答案】:(C) 【解析】:(A)此反應中 Al2O3+N2+3C |