|
|
|
||||||||||||||||||||||||||||||||||||||||
|
(一)
酸與鹼 A、
酸的定義: (1)電解質溶於水,能離出【H+】離子的,即稱為酸。 (2)不同種類的酸性物質,在水中的溶解度及解離度均不同。 (3)在水中游離度大的酸即為強酸;屬於強電解質。 (4)在水溶液中,每個分子能解離出1個H+離子者,稱為單質子酸,能解出出2個H+離子者,稱為雙質子酸。 B、
鹼的定義: (1)電解質溶於水,能由離出【OH-】離子的,即稱為酸。 (2)不同種類的鹼性物質,在水中的溶解度及解離度均不同。 (3)在水中游離度大的鹼即為強鹼;屬於強電解質。 (4)在水溶液中,每個分子能解離出1個OH-離子者,稱為一元鹼,能解出出2個OH-離子者,稱為二元鹼。 (二)
酸的通性: A、
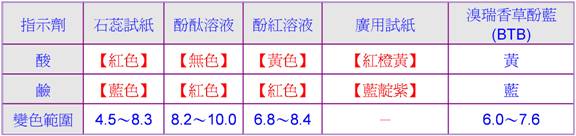
所有的酸都含有共同離子【OH-】。 B、 指示劑檢驗: C、
稀酸遇活性大的金屬(例:Mg、Al、Zn、Fe)會產生【氫氣(H2)】。 D、
稀酸遇灰石(學名:【碳酸鈣】,化學式:【CaCO3】會產生【CO2】氣體。 E、
將濃酸稀釋成稀酸時會【放】熱。 F、
酸能導電,為【電解質】。 G、
酸嚐起來有【酸】味。 (三)
鹼的通性: A、
含有【OH-】共同離子; B、
指示劑檢驗,呈【鹼性】反應; C、
為【電解質】; D、
可溶解【脂肪】或【油】(作【溶劑】); E、
嚐起來有【澀味】,摸起來有【滑膩感】。 F、
鹼的解離方程式: (1)NaOH →【Na++OH-】; (2)Ca(OH)2
→【Ca2++2OH-】; (3)NH4OH
→【NH4++OH-】; G、
強鹼和弱鹼:水溶液中容易解離出【OH-離子】的為【強鹼】; H、
解離度【大】者為強鹼,解離度【小】者為弱鹼。 I、
【鹼金族】和【鹼土族】的氫氧化物, 都可視為強鹼。 J、
氫氧化鈉【NaOH】、氫氧化鉀【KOH】、氫氧化鋇【Ba(OH)2】、氫氧化鈣【Ca(OH)2】為強鹼;氨氣(【NH3】)和氫氧化鋁(【Al(OH)3】)的水溶液可視為弱鹼。 (四)
酸鹼中和: A、
酸+ 鹼→鹽 + 水 [例]: NaOH + HCl → 【NaCl+H2O】; [例]: Ca(OH)2 + 2HNO3 → 【Ca(NO3)2+H2O】;
不同的酸與鹼反應,所產生的離子方程式反應相同。
硫酸鈣為【硫酸H2SO4】(酸)和【氫氧化鈣Ca(OH)2】(鹼)中和而得;
硝酸銨為【硝酸HNO3】(酸)和【氫氧化銨NH4OH】(鹼)中和而得;
氯化鋇為【鹽酸HCl】(酸)和【氫氧化鋇Ba(OH)2】(鹼)中和而得;
碳酸鈉為【碳酸H2CO3】(酸)和【氫氧化鈉NaOH】(鹼)中和而得; B、
活性大的金屬和稀酸反應,可以產生鹽: [例]: Mg +2HCl →【MgCl2+H2】;
Fe +2HCl →【FeCl2 (氯化亞鐵)+H2】;
硝酸銅為【稀硝酸(或濃硝酸)】和【銅】反應所製得;
氯化鎂為【稀鹽酸】和【鎂】反應所製得;
硫酸銅為【濃硫酸】和【銅】反應所製得; |
|
||||||||||||||||||||||||||||||||||||||||
|
(五)
PH值和氫離子濃度 A、
純水的解離: (1)純水並非完全不解離,但其解離的數目很小。 (2)根據實驗發現:純水的解離方程式為: H2O → 【H+】 +【OH-】
在
產生解離的 H+ 莫耳數有【10-7】莫耳,
OH- 莫耳數有【10-7】莫耳。
[H+] = B、
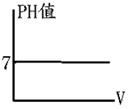
溶液的酸鹼性: (1)純水中(中性溶液): [H+]=[OH-]=【10- (2)酸性溶液:[H+]>[OH-] 即:[H+] 【>】10- (3)鹼性溶液:[H+]<[OH-] 即:[H+] 【<】10- 一般在室溫下,任何的溶液: [H+]×[OH-]=【10-
|
|
||||||||||||||||||||||||||||||||||||||||
|
(一) 氫離子濃度和PH值 規定: [H+]= 10-a M
PH值 =【a】 [OH-]=10-b M
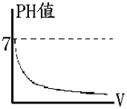
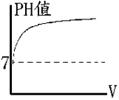
POH值 =【b】 註: (1)PH值愈小,則【H+】濃度愈大,【酸性】愈強,【鹼性】愈弱。 PH值愈大,則【OH-】濃度愈大,【鹼性】愈強,【酸性】愈弱。
(2)PH值不一定是整數,可以是小數,亦可以為負數。
(3)血液PH值【大於】7,屬於【弱鹼性】;尿液PH值【小於】7,屬於【弱酸性】;
牛奶PH值【小於】7,屬於【弱酸性】;海水PH值【大於】7,屬於【弱鹼性】。 【題型一】PH值的基本換算:
|
|
||||||||||||||||||||||||||||||||||||||||
|
【題型二】PH值
和 POH值
的範圍:
|
||||||||||||||||||||||||||||||||||||||||||
|
【題型三】原子量:Na=23、Ca=40、N=14、Cl=35.5、S=32、K=39、Mg=24
|
||||||||||||||||||||||||||||||||||||||||||
|
7.
[OH-]= 4×10-1 M:
(4)[H+]=【2.5×10-14】M;
(5)PH 值的範圍為【13<PH<14】,
(6)POH 值的範圍為【0<POH<1】; [H+][OH-]=10- 10-1<4×10-1<100 [ 1>POH值>0 |
8.
[OH-]= 2×10-1 M:
(4)[H+]=【5×10-14】M;
(5)PH 值的範圍為【13<PH<14】,
(6)POH 值的範圍為【0<POH<1】; [H+][OH-]=10- 10-1<2×10-1<100 [ 1>POH值>0 |
|
|
9.
[OH-]= 5×10-9 M:
(4)[H+]=【2×10-6】M;
(5)PH 值的範圍為【5<PH<6】,
(6)POH 值的範圍為【8<POH<9】; [H+][OH-]=10- 10-6<2×10-6<10-5 [ 6>PH值>5 |
10.
[H+]= 4×10-14 M:
(4)[OH-]=【2.5×10-1】M;
(5)PH 值的範圍為【13<PH<14】,
(6)POH 值的範圍為【0<POH<1】; [H+][OH-]=10- 10-14<4×10-14<10-13 [14>PH值>13 |
|
|
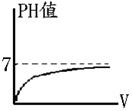
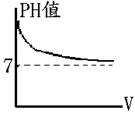
【題型四】:稀釋 |
||
|
1.
將0.1M氫氧化鈉 50 毫升稀釋成 (1) [OH-]=【10- (2) [H+] =【10- [NaOH]= [ [OH-]=10-
[H+]=10- |
2. PH=12的氫氧化鈉40毫升稀釋成 (1) 稀釋後的
[H+] =【5×10- (2) 稀釋後的
POH =【2×10- PH值=12 [ [H+]=10- [OH-]=10-
[H+]= |
|
|
3. 將0.5
M硫酸40毫升,稀釋成400毫升: (1) [OH-]=【10- (2) [H+] =【0.1】; [H2SO4]= 稀釋後的[H+]= [OH-]=10- |
4. 將PH=1的硫酸200
毫升稀釋成 (1) 稀釋後的
[H+] =【4×10- (2) 稀釋後的
POH =【12>POH值>11】; PH值=1
[ [H+]=10- 稀釋後的[H+]= [OH-]= 10-12<2.5×10-12<10-11[ 12>POH值>11 |
|
|
5. 將0.05M 氫氧化鋇40毫升稀釋成4升: (1) [OH-]=【10- (2) [H+] =【10- [Ba(OH)2]= 稀釋後的[OH-]= [H+]=10- |
6. 將PH=11
的氫氧化鈣10毫升稀釋成1升: (1) 稀釋後的
[H+] =【10-9M 】, (2) 稀釋後的
POH 值=【5】; PH值=11
[
[H+]=10-11M 稀釋後的[OH-]= [
[H+]=10-9 M |
|
|
【題型五】:酸鹼混合(一) |
|
|
2.
將0.02M硝酸40毫升和0.01M硫酸60毫升混合,混合後[H+] =【2x10-2M】; 莫耳數=莫耳濃度x升數=MxL |
3.
將0.02M硫酸40毫升和0.01M鹽酸10毫升混合,混合後的[H+]=【3.4x10-2M】; 莫耳數=莫耳濃度x升數=MxL |
|
4.
將PH=13氫氧化鈣100 ml和0.2M氫氧化鈉400 ml混合, 莫耳數=莫耳濃度x升數=MxL |
5.
將0.2M氫氧化鉀40毫升和0.5M氫氧化鈉 莫耳數=莫耳濃度x升數=MxL |
|
6.
將PH=2的硝酸200毫升和PH=3的 PH=2,[H+] =10-2M=0.01M, PH=3,[H+] =10-3M=0.001M |
7.
PH=1的硝酸100毫升和0.4M的鹽酸400
PH=1,[H+] =10-1M=0.1M, 莫耳數=莫耳濃度x升數=MxL [H+]= |
|
【題型六】:酸鹼混合(二) |
|
|
1.
將0.2M鹽酸溶液200毫升與0.5M氫氧化鈉溶液300毫升混合,則溶液最後的[H+]濃度為【4.55x10-14M】。 H+莫耳數=0.2x0.2=0.04莫耳 OH-莫耳數=0.5x0.3=0.15莫耳 |
2.
將2M硝酸溶液4升與1M氫氧化鈉溶液1升混合,溶液最後[H+]濃度為【1.4】M。 H+莫耳數=2x4=8莫耳 OH-莫耳數=1x1=1莫耳 |
|
3.
將1M硫酸溶液400毫升與2M氫氧化鈣溶液600毫升混合,則溶液最後的[OH-]濃度為【1.6 M】。 H+莫耳數=1x2x0.4=0.8莫耳 OH-莫耳數=2x2x0.6=2.4莫耳 |
4.
將2M硝酸溶液800毫升與5M氫氧化鎂溶液200毫升混合,則溶液最後的[H+]濃度為【2.510-14 M】。 H+莫耳數=2x0.8=1.6莫耳 OH-莫耳數=5x0.2x2=2莫耳 最後的[H+]= |
|
【題型七】:酸鹼中和 |
|
|
5.
今有 0.2 M 鹽酸溶液 20 毫升,欲將其 H+莫耳數=OH-莫耳數 0.2×20 = 0.5×X X=8毫升 |
6.
今有0.2M的硫酸溶液40毫升,欲將其中 H+莫耳數=OH-莫耳數 (0.2×2) × 40 =
0.4 × X X=40毫升 |
|
7.
今有0.05M 的硫酸溶液20毫升,欲將其 H+莫耳數=OH-莫耳數 (0.05×2)×20 = (0.5×2) ×X X=2毫升 |
8.
今有PH=1的硫酸溶液40 毫升,欲將其 PH=1 [H+]=10- PH=12
[H+]=10- H+莫耳數=OH-莫耳數 0.1× 40 = 0.01 × X X=400毫升 |
|
9.
欲中和 0.05 M 的氫氧化鉀溶液 60 毫 H+莫耳數=OH-莫耳數 0.05 × 60 = (0.02×3) × X X=50毫升 |
10.
欲中和0.4M 的氫氧化鋇溶液100毫升, H+莫耳數=OH-莫耳數 (0.4×2) × 100 = 0.5 × X X=160毫升 |
|
11.
欲中和 PH=12 的氫氧化鈣溶液 200 PH=12 [H+]=10- H+莫耳數=OH-莫耳數 0.01× 200 = 0.05 × X X=40毫升 |
12.
欲中和 PH= 13 的氫氧化鈉溶液 40 毫 PH=13 [H+]=10- PH=2 [H+]=10- H+莫耳數=OH-莫耳數 0.01× X = 0.1 × 40 X=400毫升 |