|
|
||||||||||||||||||||
|
【前言】依道耳頓的原子說,化學反應時,原子重新排列與組合;而原子的重新排列與組合牽涉到電子的共用與轉移,因此電子的排列方式,決定原子的化學性質。 |
||||||||||||||||||||
|
(一)
電子排列的模型 A、
拉塞福的行星模型:
(1) 拉塞福認為,電子沿一定的軌道繞原子核作圓周運動,如同行星繞太陽一般,有一定的軌跡。
(2)
(3) 研究顯示,電子在原子核外一定的範圍運轉,形成雲狀分布,稱為電子雲;電子雲由許多小黑點組成,每一個小黑點表示電子曾在該處出現的痕跡。
(4) 電子雲表示電子曾在原子核附近的空間出現的機率,若電子雲愈密,則表示電子出現在該空間的機率愈大。 B、
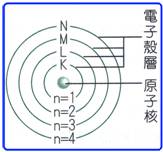
電子殼層:
(1) 由電子雲的分布顯示,電子並不是沿著特定半徑的軌道運轉,而是像洋蔥一般,有些厚度,稱為殼層,殼層是電子運行的空間,沒有電子的離子,如H離子,就不會出現殼層。
(2) 每一個殼層最多可以容納2n2個電子。
(3) 電子殼層由內而外,分別以n=1、2、3......標示,n稱為主量子數; n=1時,最接近原子核,能量最低,也最穩定;n值愈大時,離原子核愈遠,能量也愈高。
(4) 電子由內層而外層依次排列,每一殼層的電子有特定的能量。
(5) 能量由低到高的順序,如同階梯一般的排列,稱為能階,電子在兩能階間跳躍時,會有能量轉換,由低能階到高能階,需要吸收能量;由高能階到低能階,需要放出能量。
【例1】 有關殼層的敘述,下列何者正確? 【答案】:(B)(C) 【解析】:(A) 第二主殼層是L層,M層是第三殼層。 【例2】 有關價殼層的敘述,下例何者正確? 【答案】:(E) 【解析】:(A) 價殼層為電子殼層的最外層。 【例3】 主殼層M最多可容納的電子數為 (A)2 (B)8 (C)18 (D)32 (E)50。 【答案】:(A)(B) 【解析】:主殼層為n=1時稱為K層,能容納的總電子數=2n2=2x12=2。 【例4】 下列有關軌域的敘述,何者正確? 【答案】: (B) 【解析】:(A) H原子基態的軌域只有1個,但是激發態的軌域有無限多個。 【例5】 下列哪些元素的核心電子數相同? 【答案】:(C)(D) 【解析】:同一週期的元素,其內層的束縛電子(核心電子)相同,僅價電子數目不同。 【例6】 下列關於元素性質與其電子排列的敘述,何者正確? 【答案】:(A)(C)(E) 【解析】:(A) 同一族的元素,其價電子數目相同,因此化學性質相同。 【例7】 有關鈉原子電子排列方式的敍述,何者正確?(Na之原子序=11) 【答案】:(C) 【解析】:鈉金屬原子序11,其電子數為(2,8,1),因此第3層(M層)的電子數有1個。 【例8】 Na+離子可能具有下列各組粒子組合之一,其組合以(質子數,中子數,電子數)表示,應為 【答案】:(A) 【解析】:鈉的原子序為11,質量數為23,有11個質子,23-11=12個中子,鈉離子帶1個正電,墊子數=11-1=10個電子,因此 (質子數,中子數,電子數)=(11,12,10)。 【例9】 和氖原子具有相同電子殼層排列的是下列何者? 【答案】:(D) 【解析】:氖原子的原子序為10,有10個電子,電子排列為(2,8),而 【例10】 教學上有時會用電子式表示原子結構,下列選項中,阿拉伯數字代表質子數,"+"代表原子核所帶的正電荷," 【答案】:(A) 【解析】:(A)有8個正電,2+8個負電,因此為陰離子。 (B)有9個正電,2+7=9個負電,因此為電中性的原子。 (C)有10個正電,2+8=10個負電,因此為電中性的原子。 (D)有11個正電,2+8+1=11個負電,因此為電中性的原子。 (E)有12個正電,2+8個負電,因此為陽離子。 【例11】 下列何者為陽離子? 【答案】:(C) 【解析】:圖中,(A)(D)為電中性的原子; (B)為2個負電的陰離子; (C)帶1個正電的陽離子; 【例12】 請列出下列原子的電子分布情形。 【答案】:(1)(2,8,2) (2)(2,8,8,2) (3)(2,8,5) (二)
電子的排列和週期表的關係 A、
週期表的橫列稱為週期,直行稱為族。 B、
第一週期的元素最外層填到第一層;第二週期的元素最外層填到第二層;同一週期元素的價電子,由左而右依次增加。 C、
同一族的元素,有相同的價電子數(氦除外)。
D、
電子的排列:
(1)
(2)
(3)
(4)
(5)
E、
元素的化學性質:
(1) 物質的行程方式和元素的性質有關,而元素的化學性質取決於元素最外層的價電子數,因此同一族的元素,化學性質相類似。
(2) ⅠA族的元素,價電子數皆為1,稱為鹼金族,與水反應都能產生氫氣及鹼性的氫氧化物,其氧化物溶於水,都呈鹼性溶液。
(3) ⅦA族的元素,價電子數都為7,稱為鹵族元素,簡稱鹵素,其氫化物溶於水都能成為酸性溶液。
(4) 惰性氣體(ⅧA族)的化學性質最穩定,除了氦最外層僅有2個電子外,其餘都元素最外層都是8個價電子,達到飽和狀態,因此不易和其他元素相結合,在自然夜中便均以單原子的元素狀態存在。 【例13】 下列各元素之電子排列,何組最外層的電子數相同? 【答案】:(A)(B) 【解析】:同一族的元素,其價電子的排列相同。 【例14】 關於鹼金族及鹵素性質的比較,何者正確? 【答案】: (B) 【解析】:(A)鹵素(Cl、Br、I)有可能出現正的氧化數,如HClO3中Cl為+5。 【例15】 關於分子的電子點式,書寫正確的是 【答案】: (C) 【解析】:(A) (三)
元素性質的規律性 A、
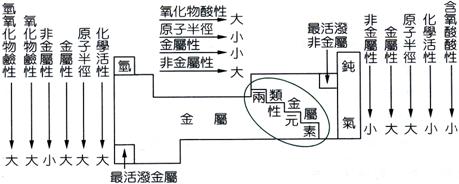
原子半徑的規律性:
(1) 同族元素的原子半徑,隨著原子序的增大而增加(原子半徑由上而下增加);即原子序愈大,電子殼層愈大。
(2) 同週期A族的原子半徑,隨著原子序的增加而減少(原子半徑由左而右漸減);即原子序愈大,核電荷與核外的電子靜電力愈強,因此原子序愈大,距離愈近,原子半徑愈小。
(3) 同週期的過渡性元素(B族元素),由左而右,由於遮蔽效應,因此半徑的變化不明顯。 B、
離子半徑的判斷:
(1) 陽離子由於失去電子,因此陽離子的離子半徑比原子半徑小。
(2) 陰離子由於獲得電子,因此陰離子的離子半徑比原子半徑大。
(3) 電子殼層相同的粒子,其原子半徑隨著原子序的增加而減少。
(4) 同一族的元素形成相同電核的離子時,離子半徑隨著原子序的增加而增加。
(5) 同一元素形成不同電荷的陽離子時,離子半徑隨著正電荷數的增加而減少。
(6) 甲、 陰離子>中性原子>陽離子。 乙、 陽離子電荷多者,半徑較小。 丙、 陰離子電荷較多者,半徑較大。 丁、 同一種粒子,電子數愈多,則半徑愈大。 【例16】 下列有關鈉與鎂的比較,何者正確?(原子序 Na=11,Mg=12) 【答案】: (B) 【解析】:(A)
質子數:Na有11個,Mg有12個。 【例17】 比較下列各離子半徑的大小: 【答案】: (1) >;
(2) >; (3) >; (4) <; C、
元素性質的傾向
(1) 低價金屬氧化物溶於水,呈鹼性;非金屬氧化物溶於水,呈酸性;不溶於水的氧化物,則成中性。
(2) 週期表左下方的元素,有成為鹼性特性的金屬;
(3) 同一週期由左而右,非金屬性質逐漸增強,而金屬性質逐漸減弱。
(4) 同一族的元素,金屬性質由上而下,逐漸增強;非金屬性質由上而下,則逐漸減弱。
(5) 兩性元素: 甲、 氧化物或氫氧化物同時具有酸性及鹼性的特性者,稱為兩性元素。
(6) 類金屬元素: 甲、 又稱為半導體元素,導電性介於金屬與非金屬之間。
【例18】 下列何種元素的電子排列,最外層的電子數與 【答案】:(D) 【解析】:同一族的元素,價電子數目相同。 【例19】 下列各組的原子或離子中,依半徑大小由小到大的順序排列的是 【答案】:(A)(B) 【解析】:(A)K+電子組態(2,8,8)在第三週期全滿,半徑最大;Na+的電子組態(2,8),Al3+的電子組態(2,8),因原子核內質子Al較多,因此Al3+半徑小於Na+;依序為Al3+<Na+<K+。 【例20】 下列結構示意圖中,屬於陽離子的是【臺中二中】 【答案】:(D) 【解析】:(A)(C)為中性原子;(B)為陰離子( (四)
A、
八隅體法則:
(1) 自然界中元素的最外層電子為8 (氦為2) 時的鈍氣型態是最安定,因此在化學反應時,元素間常藉著最外層電子的轉移或共用,形成與ⅧA族鈍氣相同的電子組態,成為安定的分子或是離子;因此失去電子時,成為陽離子,得到電子時,成為陰離子,當電子共用時,形成分子。 B、
化學鍵的種類:
(1) 化學鍵: 甲、 原子間或是分子間的作用力,都稱為化學鍵。 乙、 新物質生成時,原子間會重新調整外層電子,或是以共用電子的方式,使原子均具有鄰近鈍氣的電子組態,同時產生引力相結合。
(2) 甲、 金屬元素和非金屬元素相結合,所形成的鍵結。 乙、 原子間發生電子轉移,形成陰離子和陽離子,藉著陰離子和陽離子間的靜電引力相互吸引而結合。 丙、 金屬與非金屬結合時,易失去電子的金屬(ⅠA、ⅡA族),與易得到電子的非金屬(ⅦA族、氧),形成離子化合物。 丁、 性質: 甲、 常溫下離子化合物為固態,有一定的結晶構造。 乙、 在固態時不能導電,但在熔融狀態或是水溶液可以導電。 丙、 離子化合物具高熔點、高沸點、質硬而脆,不具延展性。 戊、 氯化鈉(NaCl)中那失去電子,成為帶正電的陽離子,氯得到電子,成為帶負電的陰離子,彼此相結合成為離子化合物。
(3) 共價鍵:非金屬元素和非金屬元素相結合,所形成的鍵結,或是分子化合物。
(4) 金屬鍵:金屬元素和金屬元素相結合,所形成的鍵結。 【例21】 下列關於離子化合物的敘述,何者錯誤? 【答案】:(B) 【解析】: (五)
原子的電子點式表示法 A、
原子內的電子:
(1) 電子排列在最高能階的殼層,稱為價殼層。
(2) 價殼層的電子稱為價電子。
(3) 價電子參與原子間的化學反應,決定該元素的性質;
(4) 價殼層以內的電子。稱為核心電子,或稱為束縛電子。核心電子在所屬的殼層中均是填滿的,通常不參與原子間的結合。 B、
路易斯電子點式:
(1) 將價電子點在元素符號的四周,這種表示法稱為"路易斯電子點式"。
(2) 一般的化學反應中,內殼層的電子不會參與反應,因此不用畫出。
【例22】
一個水分子中有幾對孤對電子(未共用電子對)? 【答案】:(B) 【解析】: 【例23】
劃出下列各題的電子點式: 【答案】: 【例24】 下列各物質的電子點式,何者正確? 【答案】:(B) 【解析】:(A)為離子鍵結,應表示成 【例25】 水( 【答案】:(B) |